微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl。下列“水” 电池在海水中放电时的有关说法正确的是
A.每生成1 mol Na2Mn5O10转移2 mol电子
B.正极反应式:Ag+Cl--e-=AgCl
C.Na+不断向“水”电池的负极移动
D.AgCl是还原产物
参考答案:A
本题解析:
试题分析:A、根据题给电池反应知,每生成1mol?Na2Mn5O10转移2mol电子,正确;B、在原电池的正极上发生得电子的还原反应,电极反应式为5MnO2+2e-=Mn5O102-,错误;C、Na+不断向“水”电池的正极移动,错误;D、在反应中,银元素化合价升高,AgCl是氧化产物,错误。
本题难度:一般
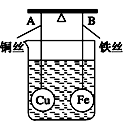
2、选择题 如图所示,杠杆AB两端分别挂有体积相同、质量相等的铜球和铁球,调节杠杆使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中不考虑铁丝反应及两球浮力的变化)??
 [???? ]
[???? ]
A.杠杆为导体和绝缘体时,均为A端高B端低
B.杠杆为导体和绝缘体时,均为A端低B端高 ????
C.当杠杆为绝缘体时,A端低B端高;为导体时,A端高B端低 ????
D.当杠杆为绝缘体时,A端高B端低;为导体时,A端低B端高?
参考答案:D
本题解析:
本题难度:一般
3、选择题 结合右图判断,下列叙述正确的是
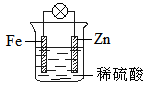
A.正极被保护
B.H+向Zn电极移动
C.加入少量KSCN溶液,变血红色
D.负极的电极反应式是:Fe-2e-=Fe2+
参考答案:A
本题解析:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。锌比铁活泼,所以锌是负极,铁是正极,溶液中的氢离子在正极得到电子,所以只有选项A正确,其余都是错误的,答案选A。
本题难度:一般
4、选择题 有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池。电池的总反应类似于CH4在O2中燃烧,则下列说法正确的是
①每消耗1 mol CH4可以向外电路提供8 mole-
②负极上CH4失去电子,电极反应式为:CH4+10OH--8e-=CO+7H2O
③负极上是O2得电子,电极反应式为O2+2H2O+4e-=4OH-
④电池工作后,溶液的pH不断升高
A.①②
B.①③
C.①④
D.③④
参考答案:A
本题解析:
试题分析:构成燃料电池,可燃气体化合价升高,在负极上失电子,发生的反应类似在氧气中燃烧,电解质是KOH溶液,CO2转成CO32-,电极反应式:CH4+10OH--8e-=CO32-+7H2O,氧气在正极上得电子,电极反应式:O2+2H2O+4e-=4OH-,总电极反应式为:CH4+2O2+2OH-=CO32-+3H2O,①分析负极上电极反应式1molCH4参加反应失去8mole-,正确;②经上面分析,正确;③经上面分析氧气在正极上得电子,错误;④根据总电极反应式,OH-被消耗,pH减小,错误,选项A正确。
考点:考查燃料电池电极反应式的书写。
本题难度:一般
5、填空题 A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
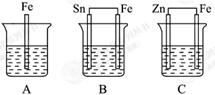
(1) A中反应的离子方程式为 。
(2)B中Sn极的电极反应式为 。Sn极附近溶液的c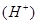 (填 “变大”“变小”或“不变”)。
(填 “变大”“变小”或“不变”)。
(3)C中被腐蚀的金属是 ,总反应的化学方程式为
,比较A、B、C中铁被腐蚀的速率,由快到慢的顺序为 (填序号)。
参考答案:(12分,每空2分)(1)Fe + 2H+= Fe + H2
本题解析:
试题分析:(1)装置A中铁直接与稀硫酸发生置换反应,反应的离子方程式是Fe + 2H+= Fe + H2↑。
(2)装置B中铁的金属性强于Sn的,则铁是负极,Sn是正极,溶液中的氢离子在正极得到电子,电极反应式是2H+ + 2e-=H2↑,所以正极周围溶液中氢离子浓度变小。
(3)装置C中锌的金属性强于铁的,锌失去电子,做负极,被腐蚀。铁是正极,被保护,总的方程式是Zn + H2SO4= ZnSO4 + H2↑。根据以上分析可知,A、B、C中铁被腐蚀的速率,由快到慢的顺序为B>A>C。
考点:考查原电池的有关应用、金属的腐蚀与防护
点评:该题是基础性试题的考查,也是高考中的重要考点。主要是考查学生对原电池原理以及金属腐蚀与防护的熟悉了解程度,意在培养学生分析、归纳和总结问题的能力。该题的关键是明确原电池的工作原理,然后结合题意灵活运用即可。
本题难度:一般