微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 有一种酸式盐AHB,它的水溶液呈弱碱性。则以下说法:
①相同物质的量浓度的AOH溶液和H2B溶液,前者的电离程度大于后者的电离程度;
②H2B不是强酸;
③HB-的电离程度大于HB-的水解程度;
④该盐溶液的电离方程式一般写成:AHB====A++HB-,HB- H++B2-
H++B2-
其中错误选项的组合是(?? )
A.①②
B.③④
C.②③
D.①④
参考答案:B
本题解析:酸式盐AHB的水溶液呈弱碱性,说明AOH的碱性相对较强,H2B的酸性相对较弱,且HB-的电离程度小于HB-的水解程度,相同物质的量浓度的AOH溶液和H2B溶液,前者的电离程度大于后者的电离程度。AHB溶液的电离方程式一般写成AHB====A++HB-,HB- H++B2-
H++B2-
本题难度:一般
2、填空题 蛇纹石是一种含水的富镁硅酸盐矿物的总称,可以看作由MgO、Fe2O3、Al2O3、SiO2组成。实验室以蛇纹石为原料制取水合碱式碳酸镁,已知:
氢氧化物
| Fe(OH)3
| Al(OH)3
| Mg(OH)2
|
开始沉淀的pH
| 1.5
| 3.3
| 9.4
|
完全沉淀的pH
| 3.7
| 5.2
| 11.0
?
实验步骤如下:
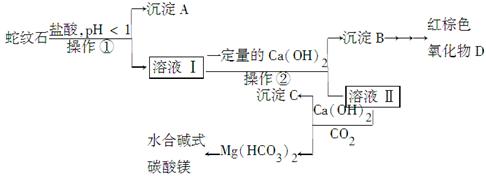
(1)实验室完成操作①所用到的玻璃仪器有:________。
(2)操作②中应控制溶液pH的合理范围是________(填序号)。
A.小于1.5 B.1.5~3.3????????? C.7~8??? D.大小9.4
(3)检验溶液Ⅱ中是否含有Fe3+的操作与结论是______________________。
(4)从沉淀混合物B中制取D,应加入一种试剂进行分离,其反应的离子方程式为________,再进行________、洗涤、________(依次填写实验操作名称)。
参考答案:(1)玻璃棒、漏斗、烧杯
(2)C
(3)取少量
本题解析:(1)操作①是过滤,所以需要的玻璃仪器是玻璃棒、漏斗、烧杯。
(2)操作②的目的是沉淀铁离子和铝离子,但不能沉淀镁离子,所以根据沉淀的pH可知,应控制溶液pH的合理范围是5.2~9.4,答案选C。
(3)检验铁离子的试剂是KSCN溶液,即取少量溶液Ⅱ于试管中,加入KSCN溶液,若无明显现象,说明溶液Ⅱ不含Fe3+;若溶液变红色,说明溶液Ⅱ含有Fe3+。
(4)B中沉淀是氢氧化铝和氢氧化铁,由于氢氧化铝是两性氢氧化物,所以得到氢氧化铁的方法是加入氢氧化钠溶液,过滤即可,反应的离子方程式是O
本题难度:困难
3、填空题 在FeCl3溶液中存在着平衡体系:Fe3++3H2O Fe(OH)3+3H+,改变条件,填写下表。(填“增大”、“减小”或“不变”及“向左”、“向右”或“不移动”) Fe(OH)3+3H+,改变条件,填写下表。(填“增大”、“减小”或“不变”及“向左”、“向右”或“不移动”)

参考答案:![]() 本题解析: 本题解析:
本题难度:一般
4、选择题 对于0.1mol?L-1?NH4Cl溶液,正确的是( )
A.升高温度,溶液pH升高
B.通入少量HCl,c(NH4+)和c(Cl-)均增大
C.c(NH4+)+c(OH-)=c(Cl-)+c(H+)
D.c(Cl-)>c(H+)>c(NH4+)>c(OH-)
参考答案:A.升高温度促进水解,NH4Cl水解,氢离子浓度增大,溶液p
本题解析:
本题难度:简单
5、填空题 (10分)已知在0.1 mol/L的NaHSO3溶液中有关微粒浓度由大到小的顺序为:
c(Na+)>c(HSO)>c(SO)>c(H2SO3)。
(1)则该溶液中c(H+)________c(OH-)(填“<”、“>”或“=”),简述理由(用离子方程式和必要的文字说明)__________________________________________________
____________??????????________。
(2)现向NaHSO3溶液中,逐滴加入少量含有酚酞的NaOH溶液,可观察到的现象是________________________________________________________________________;
写出该反应的离子方程式_____________??_________________________
参考答案:
 本题解析:略 本题解析:略
本题难度:一般
|