微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 相同温度下等物质的量浓度的下列溶液中,c(NH4+)最大的是
A.NH4Cl
B.NH4HC03
C.NH4HS04
D.NH3·H20
参考答案:C
本题解析:
正确答案:C
A、NH4Cl强电解质,NH4+ 少量水解??? B.NH4HC03强电解质,NH4+ 少量水解,HCO3―水解促进NH4+ 水解? C.NH4HS04强电解质,NH4+ 少量水解,H+ 抑制NH4+ 水解? D.NH3·H2O 弱电解质,少量电离,所以c(NH4+)最大的是C
本题难度:一般
2、选择题 在25℃时,pH等于11的NaOH溶液和NaCN溶液,两溶液中水的电离度大小的比较正确的是()
A.相等
B.后者比前者大11倍
C.后者是前者的108倍
D.前者是后者的108倍
参考答案:C
本题解析:pH=11的NaOH溶液中水的电离度为α1=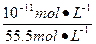 ,pH=11的NaCN溶液中水的电离度为α2=
,pH=11的NaCN溶液中水的电离度为α2=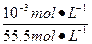 ,则
,则 本题难度:简单
本题难度:简单
3、选择题 下列说法中,不正确的是(???)
A.在NaAlO2溶液中,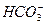 不可能大量存在
不可能大量存在
B.在0.1 mol·L-1的氢溴酸中加入适量的蒸馏水,溶液的c(H+)减小
C.在由水电离出的c(OH-)=1×10-12 mol·L-1的溶液中,Al3+不可能大量存在
D.室温下pH=6的酸性溶液中,可能存在NH3·H2O分子
参考答案:C
本题解析:A项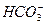 酸性强于氢氧化铝的酸性,向NaAlO2溶液中加入
酸性强于氢氧化铝的酸性,向NaAlO2溶液中加入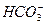 可发生
可发生 本题难度:简单
本题难度:简单
4、选择题 在常温下,下列有关溶液中微粒的物质的量浓度关系正确的是
A.1 L 0.1 mol·L-1(NH4)2Fe(SO4)2·6H2O的溶液中:c(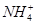 )+c(Fe2+)+c(H+)=c(OH-)+c(
)+c(Fe2+)+c(H+)=c(OH-)+c( )
)
B.0.1 mol·L-1 NH4HS溶液中:c(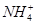 )=c(HS-)+c(H2S)+c(S2-)
)=c(HS-)+c(H2S)+c(S2-)
C.0.1 mol·L-1 pH为4的NaHA溶液中:c(HA-)>c(H2A)>c(A2-)
D.等浓度的碳酸钠和碳酸氢钠溶液混合后的溶液中:2c(OH-)+c(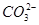 )=c(
)=c(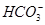 )+3c(H2CO3)+2c(H+)
)+3c(H2CO3)+2c(H+)
参考答案:D
本题解析:A项溶液中电荷守恒关系为c(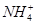 )+2c(Fe2+)+c(H+)=c(OH-)+2c(
)+2c(Fe2+)+c(H+)=c(OH-)+2c( 本题难度:一般
本题难度:一般
5、填空题 (12分)在生产生活和科学研究中,人们常常根据需要促进或抑制盐的水解。试回答下列问题:
(1)FeCl2溶液呈????(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):?;实验室在配制FeCl2溶液时,常将FeCl2固体先溶于较浓的盐酸中,以???(填“促进”、“抑制”)其水解,然后再用蒸馏水稀释到所需的浓度。
(2)用离子方程式表示硫酸铝溶液和碳酸氢钠溶液混合时发生的主要反应????。
(3)为证明盐的水解是吸热的,四位同学分别设计了如下方案,其中正确的是????。
A.甲同学:在盐酸中加入氨水,混合液温度上升,说明盐类水解是吸热的。
B.乙同学:将硝酸铵晶体溶于水,水温降低,说明盐类水解是吸热的。
C.丙同学:在氨水加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热的。
D.丁同学:在醋酸钠溶液中滴加2滴酚酞试剂,加热后红色加深,说明盐类水解是吸热的。
(4)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是???。
参考答案:(1)?酸??Fe2++2H2O 本题解析:(1)氯化亚铁是强酸铁弱碱盐,水解显酸性,因此增大氢离子浓度,能抑制其水解。
本题解析:(1)氯化亚铁是强酸铁弱碱盐,水解显酸性,因此增大氢离子浓度,能抑制其水解。
(2)硫酸铝水解显酸性,碳酸氢钠水解显碱性,所以二者混合时水解相互促进,生成氢氧化铝沉淀和CO2气体。
(3)A不正确,因为中和反应是放热反应。B不正确,硝酸铵溶于水是吸热过程。C不正确,因为是增大了NH4+的浓度,抑制了氨水的电离,所以pH减小。因此选项D是正确,红色加深,说明升高温度,平衡向正反应方向移动,即水解是吸热反应。
(4)氯化铝溶液中存在水解平衡AlCl3+3H2O 本题难度:简单
本题难度:简单