微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列水解的离子方程式正确的是
A.S2-+2H2O H2S+2OH-
H2S+2OH-
B.Fe3++3H2O Fe(OH)3+3H+
Fe(OH)3+3H+
C.CO32-+H2OHCO3-+OH-
D.HS-+H2O H2S↑+OH-
H2S↑+OH-
参考答案:B
本题解析:
试题分析:A、S2?分步水解,错误;B、Fe3+水解生成Fe(OH)3和H+,正确;C、CO32?部分水解,应该用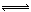 ,错误;D、HS?微弱水解,生成少量H2S,不能用↑符号,错误。
,错误;D、HS?微弱水解,生成少量H2S,不能用↑符号,错误。
本题难度:一般
2、填空题 (6分)25℃时,现有浓度均为0.10 mol/L的两种溶液:① (NH4)2SO4溶液、② Na2SO4溶液。请回答:
(1)两种溶液中,pH<7的是?????(填“①”或“②”),其原因是?????(用离子方程式表示)。
(2)下列说法正确的是?????(填序号)。
① (NH4) 2SO4是弱电解质
② (NH4) 2SO4和Na2SO4均能促进水的电离
③两种溶液等体积混合后,溶液中离子浓度大小关系为:c(Na+)= c(SO42-)>c(NH4+)>c(H+)>c(OH-)
参考答案:(6分)(1)?①??? 本题解析:
本题解析:
试题分析:(1)硫酸钠是不水解的,溶液显中性。而硫酸铵是强酸弱碱盐,NH4+水解,溶液显酸性。
(2)硫酸铵在溶液中是完全电离的,属于强电解质,①不正确;硫酸钠不水解,不能促进水的电离,②不正确,所以正确的答案选③。
点评:盐类水解的规律是:有弱才水解、无弱不水解、越弱越水解、都弱都水解、谁强显谁性。
本题难度:一般
3、选择题 下列有关电解质溶液中微粒的物质的量浓度关系正确的是(???? )
A.pH=3的一元酸和pH=11的一元强碱等体积混合后的溶液中:c(OH-)=c(H+)
B.在0.1 mol·L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3)
C.已知叠氮酸(HN3)与醋酸酸性相近,则在NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(OH?)>c(N3?)>c(H+)
D.0.2 mol·L-1NaHCO3溶液中加入等体积0.1 mol·L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
参考答案:B
本题解析:
试题分析:A、pH=3的一元强酸和pH=11的一元强碱等体积混合后的溶液中:c(OH-)=c(H+),pH=3的一元弱酸和pH=11的一元强碱等体积混合后的溶液中:c(OH-)<c(H+),错误。B、根据溶液中质子守恒得c(OH–) = c(H+) + c(HCO3–) + 2c(H2CO3–),所以c(OH–)-c(H+) = c(HCO3–) + 2c(H2CO3–),正确。C、醋酸根离子可水解,因此醋酸钠溶液显碱性,但水解程度小,c(CH3COO–)>c(OH–),NaN3与CH3COONa
本题难度:一般
4、选择题 在水中加入下列物质,可使水的电离平衡正向移动,且所得溶液呈酸性的是(?????)
A.NaCl
B.H2SO4
C.Na2CO3
D.NH4Cl
参考答案:D
本题解析:略
本题难度:简单
5、选择题 某溶液中含有HCO3-、SO32-、CO32-、HCOO-等四种阴离子,向其中加入足量的Na2O2固体后,假设溶液体积无变化,溶液中离子浓度基本保持不变的是 [???? ]
A.HCO3-
B.SO32-
C.CO32-
D.HCOO-
参考答案:D
本题解析:
本题难度:一般