OH- Cl- CO32- NO3- SO4-
?
分别取它们的水溶液进行实验,结果如下:
①A溶液与C溶液混合后产生蓝色沉淀,向该沉淀中加入足量稀HNO3,沉淀部分溶解,剩余白色固体;
②B溶液与E溶液混合后产生红褐色沉淀,同时产生大量气体;
③少量C溶液与D溶液混合后产生白色沉淀,过量C溶液与D溶液混合后无现象;
④B溶液与D溶液混合后无现象;
⑤将38.4 g Cu片投入装有足量D溶液的试管中,Cu片不溶解,再滴加1.6 mol·L-1稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。
(1)据此推断A、C的化学式为:A?????????????;C?????????????。
(2)写出步骤②中发生反应的化学方程式???????????????????????????????????。
(3)D溶液中滴入石蕊试液,现象是??????????????????????????????????????????,
原因是????????????????????????????????????????????(用离子方程式说明)。
(4)步骤⑤中若要将Cu片完全溶解,至少加入稀H2SO4的体积是???????????????mL。
(5)现用500 mL 3 mol·L-1的E溶液充分吸收11.2 L CO2气体(标准状况 下),反应后溶液中各离子的物质量浓度由小到大的顺序为????????????????????????????????。
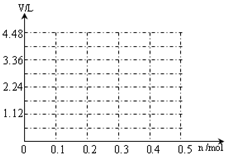
(6)若用惰性电极电解A和B的混合溶液,溶质的物质的量均为0.1 mol,请在坐标系中画出通电后阳极产生气体的体积(标准状况下)V与通过电子的物质的量n的关系(不考虑气体溶于水)。
 ’ ’
参考答案:(1)CuSO4? Ba(OH)2(各1分)
(2)2
本题解析:
试题分析:由①知,A、C反应产生的沉淀中应是氢氧化铜和硫酸钡沉淀;则A、C是CuSO4、Ba(OH)2中的一种;由②知,B、E只能是盐类,双水解产生气体和沉淀,其中含有Fe3+、CO32-,且其中必有Na2CO3;由③知C为强碱,所以C是Ba(OH)2,A是CuSO4;D为铝盐;由②④知,E为Na2CO3;由⑤知D中有NO3-,所以D为Al(NO3)3,则B只能为FeCl3。
(1)A、C的化学式为:CuSO4、Ba(OH)2
(2)步骤②是Fe3+、CO32-的双水解反应,化学方程式
本题难度:困难
2、选择题 25℃时,0.1mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH的关系如图所示。下列有关溶液中离子浓度关系叙述正确的是???

A.W点所示的溶液中:c (Na+)+c (H+)="2c" (CO32— )+c (OH— )+c (Cl— )
B.pH= 4的溶液中:c (H2CO3)+c (HCO3—)+c (CO32—)<0.1mol·L—1
C.pH=8的溶液中:c (H+)+c (H2CO3)+c (HCO3—)=" c" (OH— )+c (Cl— )
D.pH=11的溶液中:c (Na+)>c (Cl— )>c (CO32— )>c (HCO3— )>c (H2CO3)
参考答案:B
本题解析:
试题分析:根据电荷守恒可知,溶液中离子应该满足关系式c(Na+)+ c(H+)=2c(CO32-)+ c(OH-)+ c(Cl-) + c(HCO3-),A不正确;pH=4,说明反应中有CO2生成,所以根据物料守恒可知c(H2CO3)+ c(HCO3-)+ c(CO32?-)<0.1 mol·L-1,B正确;根据图像可知pH=8时,溶液中碳酸氢钠的远远大于碳酸钠的浓度,这说明反应中恰好是生成碳酸氢钠,则根据物料守恒可知c(H2CO3)+ c(HCO3-)+ c(CO32?-)=c(Cl-)=
本题难度:一般
3、选择题 以下对298K时,pH值为9的KOH溶液和pH值为9的Na2CO3溶液中由水电离出的[OH-]
的比较,正确的是 (?????? )
A.两者相等
B.前者是后者的105倍
C.后者是前者的104倍
D.无法比较
参考答案:C
本题解析:pH值为9的KOH溶液对水的电离有抑制作用,则由水电离出的[OH-]=10-5mol/L;而pH值为9的Na2CO3溶液对水的电离有促进作用,则由水电离出的[OH-]=10-5mol/L。
本题难度:简单
4、填空题 (5分)氨气的水溶液称为氨水,它的主要存在微粒是NH3·H2O。已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5mol/L?? b.CH3COOH+NaHCO3=CH3COONa +CO2↑+H 2O +CO2↑+H 2O
则CH3COONH4溶液呈?????????性(填“酸”、“碱”或“中”),NH4HCO3溶液呈????性(填“酸”、“碱”或“中”),NH4HCO3溶液中浓度最大的离子是???????(填离子的化学式)。
参考答案: 本题解析:略 本题解析:略
本题难度:一般
5、选择题 下列各溶液中,微粒的物质的量浓度关系正确的是( )
A.0.1 mol /L的(NH4)2SO4溶液中:c (SO42—)> c (NH4+ )> c (H+)> c (OH—)
B.0.2 mol /L的Na2CO3溶液中:c (OH—)= c (HCO3—)+ c (H+)+ c (H2CO3)
C.0.1 mol /L的NH4Cl溶液与0.05 mol L-l的NaOH溶液等体积混合,其混合溶液中:c (Cl-) > c (NH4+ ) > c (Na+ ) > c (H+) > c (OH-)
D.c (NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4C1溶液中:
c [(NH4)2SO4] < c [(NH4)2CO3] < c (NH4C1)
参考答案:D
本题解析:A错,正确为:c (NH4+ )>c (SO42—)> c (H+)> c (OH—);B错,正确为:c (OH—)= c (HCO3—)+ c (H+)+2 c (H2CO3);C错,正确为:c (Cl-) > c (NH4+ ) > c (Na+ ) > c (OH-)> c (H
本题难度:一般
|