微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用0.1mol·L-1 AgNO3溶液分别滴定20.00mL浓度均为 0.1mol·L-1 Cl-、Br-、I-溶液,以滴入的AgNO3溶液体积为横坐标, pX为纵坐标[pX=-lgc(X-),X=Cl-、Br-、I-],可绘得下图滴定曲线。已知25℃时:
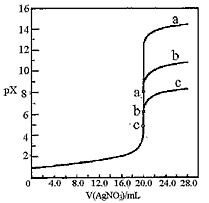

有关说法不正确的是 [???? ]
A.用硝酸银滴定法测定试样中c(Cl-),可滴加0.1mol·L-1 K2CrO4 溶液1~2滴作指示剂
B.a、b、c依次分别表示Cl-、Br-及I-
C.向NaCl和NaBr的混合溶液中滴加硝酸银溶液, 当两种沉淀共存时,c (Br-)/c(Cl-) =2.7×10-3
D.若用硝酸银溶液滴定NaI溶液,当pX=13时, 溶液中c (Ag+)≈0.64×10-17
参考答案:BD
本题解析:
本题难度:一般
2、选择题 一定温度下,向含有AgCl(s)的饱和AgCl溶液中加水,下列叙述正确的是(??)
A.AgCl的溶解度增大
B.AgCl的溶解度增大,Ksp不变
C.C(Ag+)增大
D.AgCl的溶解度、Ksp均不变
参考答案:D
本题解析:
试题分析:A.加入水多,溶解的氯化银质量多,AgCl的溶解度是指一定温度下,100g水中溶解AgCl的最大质量,与加入水的多少无关,错误;B.AgCl的溶解度、Ksp只受温度影响,温度不变,AgCl的溶解度、Ksp不变,错误;C.温度不变,AgCl的溶解度不变,C(Ag+)不变,错误;D.AgCl的溶解度、Ksp只受温度影响,温度不变,AgCl的溶解度、Ksp不变,正确.
本题难度:一般
3、选择题 下列说法正确的是(??)
A.难溶电解质作比较时,Ksp小的,溶解度一定小
B.Ksp大小取决于难溶电解质的量,所以离子浓度改变时,沉淀溶解平衡会发生移动
C.所谓沉淀完全就是用沉淀剂将溶液中某一离子完全除去
D.温度一定,当溶液中Ag+和Cl-浓度的乘积等于Ksp时,溶液为AgCl的饱和溶液
参考答案:D
本题解析:Ksp是温度的函数,B错误;绝对不溶的物质不存在,C错误。
本题难度:简单
4、填空题 (8分)重晶石(主要成分是BaSO4)是制备钡化合物的重要原料,但BaSO4不溶于水也不溶于酸,这给转化为其他钡盐带来了困难,工业上用饱和Na2CO3溶液处理BaSO4沉淀,待达到平衡后,移走上层清夜,重复多次操作,将其转化为易溶于酸的BaCO3,再由BaCO3制备其它钡盐。
Ksp(BaSO4)=1.0×10-10????? Ksp(BaCO3)=5.0×10-10
(1)写出沉淀转化的方程式:?????????,此反应平衡常数K的值为??????????。
(2)要实现该转化C(CO32-)不低于??????????mol/L
(3)必须更换Na2CO3溶液的原因是什么????????????????????????
参考答案:(1)BaSO4(s)+Na2CO3(aq)=BaCO3(s
本题解析:(1)根据反应物和生成物可写出方程式为
BaSO4(s)+Na2CO3(aq)=BaCO3(s)+Na2SO4(aq)。
反应的平衡常数是 。
。
(2)饱和硫酸钡溶液中,SO42-浓度是5×10-5mol/L,所以此时CO32-浓度是5×10-5mol/L÷0.2=2.5×10-4mol/L。
本题难度:一般
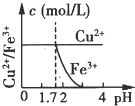
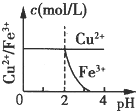
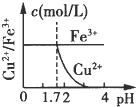
5、选择题 已知的Ksp[Cu(OH)2]=2.2×10-20、Ksp[Fe(OH)3]=4.0×10-38,Cu2+和Fe3+完全以氢氧化物沉淀时的pH分别为:6.7和3.2.现在向pH=0、浓度均为0.04mol?L-1?的Cu2+、Fe3+溶液中加入某一固体,以中和H+调节pH(设溶液体积不变),该过程中Cu2+、Fe3+的浓度与pH关系正确的是( )
A.
B.
C.
D.
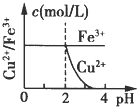
参考答案:Ksp[Fe(OH)3]=4.0×10-38,=[Fe3+]
本题解析:
本题难度:一般