微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 一水草酸钙(CaC2O4·H2O)可用作分离稀有金属的载体。其制备方法如下:
步骤I:用精制氯化钙稀溶液与草酸溶液共热反应,过滤,将固体溶于热盐酸中。
步骤Ⅱ:加氨水反应得一水草酸钙沉淀,过滤,热水洗涤,在105℃干燥得产品。
(1)写出步骤Ⅱ发生反应的化学方程式 。
(2)已知CaC2O4·H2O的Ksp = 2.34×10-9,为使步骤Ⅱ溶液中c(C2O42-)≤1×10-5 mol·L-1,c(Ca2+)的范围为 。
(3)为研究一水草酸钙的热分解性质,进行如下实验:准确称取36.50g样品加热,样品的固体残留率( )随温度的变化如下图所示。
)随温度的变化如下图所示。

①300℃时残留固体的成分为 ,900℃时残留固体的成分为 。
②通过计算求出500℃时固体的成分及质量。(写出计算过程)
参考答案:(1)H2C2O4+CaCl2+2NH3?H2O=CaC2O
本题解析:
试题分析:在步骤I得到精制H2C2O4和CaCl2,然后向该溶液中加入浓氨水发生反应产生一水合草酸钙。发生该反应的方程式是:H2C2O4+CaCl2+2NH3?H2O=CaC2O4?H2O↓+2NH4Cl+H2O;(2)由于CaC2O4·H2O的Ksp = c(C2O42-)×c(Ca2+)=2.34×10-9,所以为使步骤Ⅱ溶液中c(C2O42-)≤1×10-5 mol·L-1,c(C2O42-)×c(Ca2+)≥2.34×10-9,
(Ca2+)>2.34×10-9÷1×10-5 mol/L =2.34×10-4mol/L。即c(Ca2+)的范围为≥2.34×10-4mol/mol;(3)CaC2O4·H2O 可能发生的分解反应是:CaC2O4·H2O CaC2O4·H2O,146g CaC2O4·H2O完全分解产生128g CaC2O4, 样品的固体残留率是(128g÷146g)×100%=87.67%,所以在300℃时残留固体的成分为CaC2O4;CaC2O4·H2O
CaC2O4·H2O,146g CaC2O4·H2O完全分解产生128g CaC2O4, 样品的固体残留率是(128g÷146g)×100%=87.67%,所以在300℃时残留固体的成分为CaC2O4;CaC2O4·H2O CaCO3+CO↑+ H2O, 样品的固体残留率是(100g÷146g)×100%=68.49%, CaC2O4·H2O
CaCO3+CO↑+ H2O, 样品的固体残留率是(100g÷146g)×100%=68.49%, CaC2O4·H2O CaO+CO2↑+CO↑+H2O。(56g÷146g) ×100%=38.36%,所以在900℃时残留固体的成分为CaO;由于在500℃时固体残留率是87.67%,>76.16%>68.49%;所以固体中应该含有的CaC2O4和CaCO3。样品中CaC2O4?H2O的物质的量为n(CaC2O4?H2O)="36." 50g/146g/ mol=0.25mol;设混合物中CaC2O4和CaCO3的的物质的量分别是xmol和ymol,根据500℃时固体总质量,可得128x+100y="36." 50g×76.16%;根据Ca元素守恒,可得x+y=0.25.解放出组可得x=0.1,y="0.15" 。m(CaC2O4)=0.1mol×128g/mol=12.8g;m(CaCO3)= 0.15mol×100g/mol=15.0g。
CaO+CO2↑+CO↑+H2O。(56g÷146g) ×100%=38.36%,所以在900℃时残留固体的成分为CaO;由于在500℃时固体残留率是87.67%,>76.16%>68.49%;所以固体中应该含有的CaC2O4和CaCO3。样品中CaC2O4?H2O的物质的量为n(CaC2O4?H2O)="36." 50g/146g/ mol=0.25mol;设混合物中CaC2O4和CaCO3的的物质的量分别是xmol和ymol,根据500℃时固体总质量,可得128x+100y="36." 50g×76.16%;根据Ca元素守恒,可得x+y=0.25.解放出组可得x=0.1,y="0.15" 。m(CaC2O4)=0.1mol×128g/mol=12.8g;m(CaCO3)= 0.15mol×100g/mol=15.0g。
考点:考查温度对物质分解产物成分的影响、溶度积常数的应用、物质化学性质的方程式表示、混合物中各组分含量的计算的知识。
本题难度:困难
2、计算题 在20mL 0.0025mol·L-1 AgNO3溶液中,加入5mL 0.01mol·L-1 KCl溶液,通过计算判断是否有AgCl沉淀生成。已知Ksp(AgCl)=1.8×10-10 (混合后溶液的总体积为两者体积之和)。
参考答案:c(Ag+)×c(Cl-)>1.8×10-10,有Ag
本题解析:
试题分析:混合后溶液中的c(Ag+)=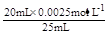 =0.0020mol·L-1 ,混合后溶液中的c(Cl-)=
=0.0020mol·L-1 ,混合后溶液中的c(Cl-)=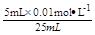 =0.0
=0.0
本题难度:一般
3、选择题 下列说法不正确的是(???)
A.不溶于水的物质溶解度为0
B.绝对不溶解的物质是不存在的
C.当残留在溶液中的离子浓度小于10-5 mol?L-1时就认为沉淀完全
D.习惯上将溶解度小于0.01g的电解质称为难溶电解质
参考答案:A
本题解析:绝对不溶的物质是不存在的,选项A不正确,其余选项都是正确的,所以正确的答案选A。
本题难度:简单
4、选择题 下列有关实验操作、现象、解释或结论都正确的是
选项
| 实验操作
| 现象
| 解释或结论
|
A
| 将灼烧变黑的热铜丝插入装少量无水乙醇的试管中
| 铜丝变红
| 乙醇和乙醛具有还原性
|
B
| 新生成的AgI浊液中滴入稀KCl溶液,振荡
| 有少量白色沉淀生成
| AgCl比AgI更难溶
|
C
| Al箔插入稀HNO3中
| 无现象
| Al箔表面被HNO3氧化,形成致密的氧化膜
|
D
| 向包有Na2O2粉末的脱脂棉吹气或滴水
| 脱脂棉都会燃烧
| Na2O2与CO2或水的反应是放热反应
参考答案:AD
本题解析:
试题分析:A、将灼烧变黑的热铜丝插入装少量无水乙醇的试管中铜丝变红,说明乙醇和乙醛具有还原性,正确;B、新生成的AgI浊液中滴入稀KCl溶液,振荡有少量白色沉淀生成,说明体系中银离子和氯离子浓度的乘积大于Ksp(AgCl),生成氯化银沉淀,不能说明AgCl比AgI更难溶,错误;C、Al箔插入稀HNO3中无现象原因是铝箔表面致密的氧化膜性质稳定不与稀硝酸反应,而不是稀硝酸将铝钝化,错误;D、向包有Na2O2粉末的脱脂棉吹气或滴水,脱脂棉都会燃烧,说明Na2O2与CO2或水的反应是放热反应,正确。
考点:考查元素化合物,实验现象的分析、评价。
本题难度:一般
5、选择题 (3分)下列说法不正确的是__________。
A.物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的;
B.对于Al(OH)3(s)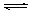 Al(OH)3(aq) Al(OH)3(aq) 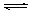 Al3++3OH-,前者为溶解平衡,后者为电离平衡; Al3++3OH-,前者为溶解平衡,后者为电离平衡;
C.除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3大
D.沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全。
参考答案:(3分)? A C
本题解析:A错,如氢氧化钠溶解会放出热量;B正确,Al(OH)3(s)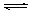 Al(OH)3(aq) Al(OH)3(aq) 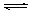 ?Al3++3OH-,前者为溶 ?Al3++3OH-,前者为溶
本题难度:一般
|