微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (14分)碘溶于碘化钾溶液中形成I3—,并建立如下平衡:I3— I—+ I2。实验室可以通过氧化还原滴定法测定平衡时I3—的浓度
I—+ I2。实验室可以通过氧化还原滴定法测定平衡时I3—的浓度
实验原理:
为了测定平衡时的c(I3—) ,可用过量的碘与碘化钾溶液一起摇动,达平衡后取上层清液用标准的Na2S2O3滴定:2 Na2S2O3 + I2 =" 2NaI" + Na2S4O6。
由于溶液中存在I3— I— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3—的总浓度,设为c1,c1 = c(I2)+c(I3—);c(I2) 的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)= c2,c(I3—)=c1 —c2;
I— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3—的总浓度,设为c1,c1 = c(I2)+c(I3—);c(I2) 的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)= c2,c(I3—)=c1 —c2;
实验内容:
1.用一只干燥的100 mL 碘量瓶和一只250 mL碘量瓶,分别标上1、2号,用量筒取80 mL 0.0100 mol.L-1 KI于1号瓶,取200 mL 蒸馏水于2号瓶,并分别加入0.5 g过量的碘。
2.将两只碘量瓶塞好塞子,振荡30分钟,静置。
3.分别取上层清液20 mL用浓度为c mol/L标准Na2S2O3溶液进行滴定。1号瓶消耗V1 mL Na2S2O3溶液,2号瓶消耗V2 mL Na2S2O3溶液。
4.带入数据计算c(I3—)
试回答下列问题
(1)标准Na2S2O3溶液应装入???(填“酸式滴定管”或“碱式滴定管”),原因是???。
(2)碘量瓶在震荡静置时要塞紧塞子,可能的原因是???
(3)滴定时向待测液中加入的指示剂是???,到达滴定终点时的现象为???。
(4)用c 、V1和V2表示c(I3—)为???mol·L-1。
(5)若在测定1号瓶时,取上层清液时不小心吸入了少量的I2固体,则测定的c(I3—)???(填“偏大”、“偏小”或“不变”)
2、填空题 (3分)25℃时,有下列四组溶液①0.1mol/L醋酸溶液,②0.1mol/L的盐酸,③pH=13的氢氧化钠溶液,④pH=13的氨水
(1)溶液中的c(H+)大小关系是???????????????(填序号,下同)。
(2)其中水的电离程度最大的是????????????。
(3)取等体积的③和④的溶液分别稀释100倍,稀释后溶液的pH关系为③?????④(填“>”、“=”、“<”)。
3、选择题 室温下,下列变化后的溶液pH小于8的是?(????)????????????????????????????
A.pH=10的氨水稀释100倍
B.pH=4的醋酸和pH=10的NaOH等体积混合
C.pH=8的NaOH溶液与pH=8的Ba(OH)2等体积混合
D.pH=11的NaOH溶液与pH=5的盐酸等体积混合
4、实验题 (12分)某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的酸度(酸度单位:g/100ml),现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。下表是4种常见指示剂的变色范围:
指示剂
| 石蕊
| 甲基橙
| 甲基红
| 酚酞
|
变色范围(PH)
| 5.0-8.0
| 3.1-4.4
| 4.4-6.2
| 8.2-10.0
(1)该实验应选用???????????????作指示剂,向锥形瓶中移取一定体积的白醋所用的仪器是?????????????????????????????。
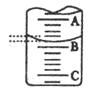
(2)下图表示50ml滴定管中液面的位置,若A与C刻度间相差1ml,A处的刻度为25,滴定管中液面读数为????????????ml。此时滴定管中液体的体积?????????????????。
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为Vml,NaOH标准液浓度为C mol/L,三次实验结果记录如下:
实验次数
| 第一次
| 第二次
| 第三次
| 消耗NaOH溶液体积/ml
| 26.02
| 25.32
| 25.28
从上表可以看出,第一次实验中记录消耗NaOH溶液体积明显多于后两次,其原因可能
是?????????????????????
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
E.滴定NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出计算该白醋中总酸度的表达式(可以不必化简):?????????????
(酸度:每100ml溶液中含有溶质酸的质量,单位:g/100ml)
5、选择题 科学家预测“氢能”将是21世纪最理想的新能源。化学家提出“硫-碘热循环法”制氢气,总反应方程式为: ,其循环过程分三步进行: ,其循环过程分三步进行:
(a) SO2+I2+2H2O=2HI+H2SO4 (b) 2HI=H2+I2 (c) 2H2SO4=2SO2+O2+2H2O。
下列分析不合理的是 (??? )
A.由于硫酸很稳定,所以反应(c)最难进行
B.该循环过程不需加热,常温下就能进行
C.反应生成的SO2和I2可以循环使用
D.“硫-碘热循环法”耗能大,若利用太阳能,可大面积推广
|
|