微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 1mol碳完全燃烧后可放出393.5KJ的热量,下列热化学方程式正确的是:?
A.C(s)+O2(g)=CO2(g);△H =" +393.5" kJ?mol-1
B.C(s)+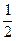 O2(g)=CO(g);△H = -393.5 kJ?mol-1
O2(g)=CO(g);△H = -393.5 kJ?mol-1
C.C+O2=CO2;△H = -393.5 kJ?mol-1
D.C(s)+O2(g)=CO2(g);△H = -393.5 kJ?mol-1
参考答案:D
本题解析:略
本题难度:简单
2、选择题 用CH4催化还原?NOx可以消除氮氧化物的污染.例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
下列说法不正确的是( )
A.若用标准状况下?4.48LCH4?还原?NO2生成N2和水蒸气,放出的热量为?173.4kJ
B.由反应①可推知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l)△H>-574?kJ?mol-1
C.反应?①②转移的电子数相同
D.反应?②中当4.48LCH4?反应完全时转移的电子总数为1.60?mol
参考答案:A、利用盖斯定律,将题中反应
本题解析:
本题难度:一般
3、选择题 工业生产水煤气的反应为:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.4kJ/mol,下列判断正确的是( )
A.反应物能量总和大于生成物能量总和
B.CO(g)+H2(g)=C(s)+H2O(l)△H=-131.4?kJ/mol
C.生产水煤气反应中,生成1L?H2(g)时吸收131.4?KJ的热量
D.有NA个H-H键形成时吸收131.4?KJ的热量
参考答案:A、反应是吸热反应,证明反应物能量低于生成物能量,故A错误;
本题解析:
本题难度:一般
4、选择题 镁粉与碘粉均匀混合,滴加几滴水,发生剧烈反应,并产生大量紫色蒸气。以下叙述错误的是
A.H2O作催化剂
B.紫色蒸气是I2
C.该反应是放热反应
D.反应后物质的总能量升高
参考答案:D
本题解析:
试题分析:能量是守恒的,由于该反应是放热的,故反应物的总能量等于放出的能量加上生成物的总能量,故反应后的总能量是降低的,错误。
本题难度:一般
5、选择题 下列说法正确的是(??)
A.1 mol 硫酸与1mol Ba(OH)2 完全中和所放出的热量为中和热
B.在25℃、101kPa下,1 mol 硫和2 mol硫燃烧热相等
C.CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,所以CO的燃烧反应一定是吸热反应
D.101 kPa时,1 mol 碳燃烧所放出的热量为碳的燃烧热
参考答案:B
本题解析:在一定条件下的稀溶液中,酸和碱作用生成1mol水时所放出的热量是中和热,A不正确。燃烧热是指在的条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,是燃烧热,所以选项B正确,D不正确。CO燃烧是放热反应,C不正确。答案选B。
本题难度:简单