微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)向MnSO4和硫酸的混合溶液里加入K2S2O8(过二硫酸钾),溶液中会发生如下反应:Mn2++ S2O82-+H2O→MnO4-+SO42一十H+该反应常用于检验Mn2+的存在。其特征现象是 。若反应中有0.1 mol还原剂参加反应,则消耗氧化剂的物质的量为 mol。
(2)若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有 。
(3)将NaBiO3固体(黄色微溶)加入到MnSO3和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应: NaBiO3+ MnSO4+ H2S04→ Na2S04+ Bi2(SO4)3+ NaMnO4+ H2O。
①配平上述反应的化学方程式;
②上述反应中还原产物是 。
③用单线桥表示该氧化还原反应 。
(4)S2O82-在一定条件下,可转变为S2O32-,写出往K2S2O3中滴加稀硫酸的离子方程式: 。
参考答案:(1)溶液由无色变为紫色;0.25 &
本题解析:
试题分析:(1)MnO4-为紫色,其它离子均为无色,则反应的现象为溶液由无色变为紫色;Mn元素的化合价升高,S元素的化合价降低,有0.1mol还原剂(MnSO4)参加反应,则消耗氧化剂的物质的量为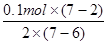 =0.25mol;
=0.25mol;
(2)硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,氯离子可能被氧化,则除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有Cl2;
(3)①Bi元素的化合价由+5价降低为+3价,Mn元素的化合价由+2价升高为+7价,结合电子守恒、原子守恒可知,反应为10NaBiO3+4MnSO4+14H2S04=3Na2S04+5Bi2(SO4)3+4NaMnO4+14H2O,故答案为:10;4;14;3;5;4;14;
②Bi元素的化合价降低,被还原,对应还原产物为Bi2(SO4)3;
③Mn失去电子,Bi得到电子,该反应中转移20e-,用单线桥表示该氧化还原反应为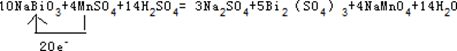 ;
;
(4)K2S2O3中滴加稀硫酸,发生氧化还原反应生成硫酸钾、S、二氧化硫和水,离子反应为S2O32-+2H+=S↓+SO2↑+H2O,故答案为:S2O32-+2H+=S↓+SO2↑+H2O.
考点:考查氧化还原反应的有关判断与计算
本题难度:一般
2、选择题 在一定条件下,RO3n-与氟气可发生如下反应:RO3n- + F2 + 2OH- = RO4- + 2F- + H2O 从而可知在RO3n-中,元素R的化合价是 [???? ]
A、+4
B、+5
C、+6
D、+7
参考答案:B
本题解析:
本题难度:简单
3、填空题 (1)黄铁矿(FeS2)是制造硫酸的矿物原料,反应历程为FeS2→SO2→SO3→H2SO4,请写出
SO2制备SO3反应的化学方程式,并用双线桥标出电子转移的方向和数目????????????;
(2)下列酸在与黄铁矿(FeS2)发生反应时,其中S或N元素的化合价不会发生变化的是??????;
a.稀硫酸?????????????b.稀硝酸??????????? c.浓硫酸??????????? d.浓硝酸
(3)从矿物学资料查得,自然界存在反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,
该反应的氧化剂为???????????????,反应中转移的电子数为?????????????NA;
(4)将(2)中反应的产物溶于水后过滤(Cu2S不溶于水和稀酸),再将滤液滴入用硫酸酸化的高锰酸钾溶液中发现溶液褪色,已知反应后锰元素呈+2价,请写出反应的化学方程式??????????????。
参考答案:
(1) 本题解析:
本题解析:
试题分析:(1)SO2在催化剂下转化为SO3即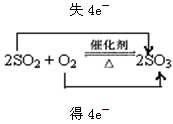
(2)a、稀硫酸是非氧化性酸,与金属反应时,氢离子显示氧化性,氧化金属,S元素价态不变,故a正确;b、稀硝酸为氧化性酸,与金属反应时,硝酸根显示氧化性,氧化金属,N元素被还原,故b错误;c、浓硫酸是氧化性酸,加热与金属反应时,硫酸根显示氧化性,氧化金
本题难度:一般
4、实验题 半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)
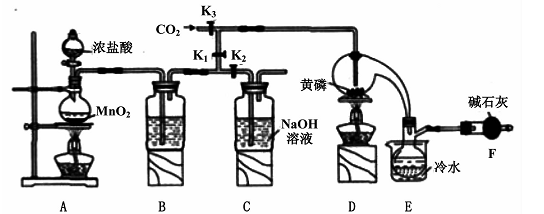
已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇水会强烈水解生成H3PO3和HCl;遇O2会生成POCl3,POCl3溶于PCl3。PCl3、POCl3的熔沸点见下表:
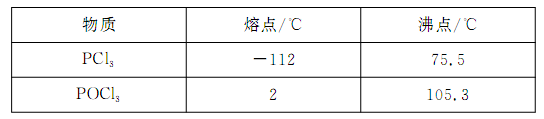
请回答下列问题:
(1)A装置中制氯气的离子方程式为 ????。
(2)B中所装试剂是?????????,E中冷水的作用是 ??????????????,F中碱石灰的作用是??????。
(3)实验时,检查装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷。通干燥CO2的作用是???????????????。
(4)粗产品中常含有POC13、PCl5等。加入黄磷加热除去PCl5后.通过??????(填实验操作名称),即可得到较纯净的PCl3。
(5)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00g产品,加水反应后配成250 mL溶液;
②取以上溶液25.00mL,向其中加入10.00 mL 0.1000 mol/L碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000 mol/L的Na2S2O3,溶液滴定
④重复②、③操作,平均消耗Na2S2O3,溶液8.40ml
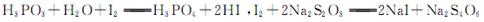 已知:??????????????????????????????????????????????????????????????????????,假设测定过程中没有其他反应。根据上述数据,该产品中PCl3的质量分数为??????????。
已知:??????????????????????????????????????????????????????????????????????,假设测定过程中没有其他反应。根据上述数据,该产品中PCl3的质量分数为??????????。
参考答案:(1)MnO2+4H++2Cl- 本题解析:
本题解析:
试题分析:(1)二氧化锰和浓盐酸加热制取氯气;(2)干燥氯气用浓硫酸;根据表中PCl3的沸点可得,用冷水可以将其冷凝;根据信息可得PCl3不能遇见水蒸气,还要考虑进行尾气处理,故碱石灰的作用为吸收多余的氯气,防止空气中的水蒸汽进入烧瓶中和PCl3反应;(3)根据题目信息可知需要排尽装置内的空气;(4)根据题目信息可知利用沸点的不同将混合物分离,故蒸馏;(5)根据碘单质和Na2S2O3的反应求出剩余的碘单质,根据总的碘单质减去剩余的碘单质求出与H3PO3的物质的量,根据磷原子守恒得PCl3的物质的量
本题难度:困难
5、选择题 标准状况下,往100 mL 0.1 mol·L-1的FeBr2溶液中通入一定体积的Cl2,充分反应后,溶液中有50%的Br-被氧化。则通入的氯气的体积是( )
A.0.224 L
B.0.336 L
C.0.448 L
D.0.672 L
参考答案:A
本题解析:
试题分析:Fe2+的还原性强于Br-,所以Cl2先氧化Fe2+,再氧化Br-。溶液中有50%的Br-被氧化时则Fe2+完全被氧化。失电子数为0.01mol+0.02mol×50%=0.02mol,所以得电子数为0.02mol,氯气的物质的量为0.01mol,氯气的体积为0.224 L。
点评:本题根据得失电子数相等计算。
本题难度:一般