微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 利用硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下:
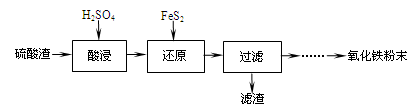
(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率,②????????????。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42-,该反应的离子方程式为
?????????????????????????????????????????????????????????????。
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。实验步骤为:
准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-=2Fe2++SnCl62-,
Sn2++4Cl-+2HgCl2=SnCl62-+Hg2Cl2↓,
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
①若SnCl2不足量,则测定的Fe3+量???????????(填“偏高”、“偏低”、“不变”,下同)。
②若不加HgCl2,则测定的Fe3+量???????????????。
(4)①可选用?????????????(填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是
?????????????????????????????????????????????(用离子反应方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物
| Fe(OH)3
| Al(OH)3
| Fe(OH)2
| Mg(OH)2
| Mn(OH)2
|
开始沉淀
| 2.7
| 3.8
| 7.5
| 9.4
| 8.3
|
完全沉淀
| 3.2
| 5.2
| 9.7
| 12.4
| 9.8
实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a. 氧化:??????????????????????????????;
b. 沉淀:???????????????????????????????;
c. 分离,洗涤;???????????? d. 烘干,研磨。
2、选择题 FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是
A 加入KSCN溶液变红色???????????? B 溶液中一定含Fe2+
C 溶液中一定含Cu2+???????????????? D剩余固体中一定含Cu
3、填空题 某同学实验探究氨气的还原性并进行系列实验。
(1)将光亮的紫红色铜丝绕几圈后,在酒精灯火焰上加热,等铜丝变黑后,趁热将铜丝插入疏松的氯化铵晶体里,即刻发现有白色烟雾生成,拿出铜丝后,铜丝又转变为光亮的紫红色。在焊接铜器时用氯化铵除去铜器表面的氧化铜即利用了该原理,请完成该反应:

(2)利用下列装置,进行与金属氧化物MxOy反应生成M、H2、H2O,通过测量生成水的质量来测定M的相对原子质量。a中试剂是浓氨水。
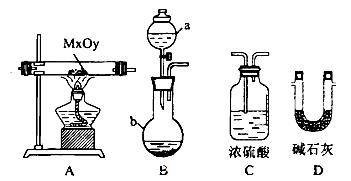
①仪器a的名称为__________,仪器b中装人的试剂可以是____________.
②按气流方向正确的装置连接顺序为(填序号,装置可重复使用):___________。
③实验结束时,应首先__________(填序号)。
I.熄灭A装置的酒精灯
II.停止从a中滴加液体
④若实验中准确称取金属氧化物的质量为mg,完全反应后,测得生成水的质量为ng,则M的相对原子质量为__________(用含X、y、m、n的式子表示)。
(3)若金属氧化物MxOy为Fe2O3,将反应后固体溶于稀硫酸,然后滴加KSCN溶液没发生明显变化。推测该固体成分可能是(将化学式填人下表,你认为有几种可能填几种)。

4、选择题 将表面有少量氧化铜的铜片,和铁片同时加入足量稀盐酸中,经充分反应后,溶液中一定含有的金属离子是
A.Fe2+
B.Fe2+和Cu2+
C.Fe3+和Cu2+
D.Fe2+和Fe3+
5、选择题 将a mol纯铁粉投入含HNO3b mol的稀溶液里,恰好完全反应并放出 NO气体,则a和b的关系是??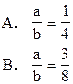
|