微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 试样A是由氧化铁和氧化铜组成.取质量相等的两份试样按下图进行实验,最后得到不溶物F和溶液G,不溶物F加入盐酸能放出气体.

(1)写出反应①中氧化铁与铝粉反应的反应方程式:______.
(2)溶液G中的溶质是______.
(3)写出反应②有关的两个离子方程式:______;______.
参考答案:依据流程图分析可知,试样A为氧化铜和氧化铁,加入过量铝粉高温
本题解析:
本题难度:一般
2、选择题 某含铬[Cr2O72-] 废水用硫酸亚铁铵[FeSO4·(NH4)2 SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀.该沉淀干燥后得到n molFeO·FeyCrxO3.不考虑处理过程中的实际损耗,下列叙述错误的是?????????????????(???)
A.消耗硫酸亚铁铵的物质量为n(2-x)mol
B.处理废水中Cr2O72-的物质量为mol
C.反应中发生转移的电子数为3nx mol
D.在FeO·FeyCrxO3中3x=y
参考答案:A
本题解析:
答案:A
反应中铁元素和铬元素完全转化为沉淀n mol FeO·FeyCrxO3,由铬原子守恒得B选项正确。1 mol Cr2O72-在反应中得6 mol 电子,1 mol Cr2O72-反应中转移的电子数为6×1mol = 3nx mol,C选项正确。沉淀中FeO的化合价没有变化,由得失电子守恒得3nx=ny, 3x=y? D选项正确。而由铁元素守恒知消耗硫酸亚铁铵的物质量为n×(1+y)mol = n×(3x+1)mol,因此选项A是错误的。
本题难度:困难
3、填空题 铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式:????????????????????????????????????。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、
负极,并写出电极反应式。
正极反应:????????????????????????????????????????????????????。
负极反应:????????????????????????????????????????????????????。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤??????????????????????????????????????????????????????。
?
| 氢氧化物开始沉淀时的pH
| 氢氧化物沉淀
完全时的pH
|
Fe3+
Fe2+
| 1.9
7.0
| 3.2
9.0
|
Cu2+
| 4.7
| 6.7
|
提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu
?
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。有关反应的化学方程式????????????????????????????;??????????????????????????????;劣质不锈钢腐蚀的实验现象????????????????????????????????????????。
参考答案:(1)2Fe3++Cu=2Fe2++Cu2+
(2)装
本题解析:(2)根据2Fe3++Cu=2Fe2++Cu2+氧化还原反应和原电池的工作原理进行设计,铜作负极,石墨作正极,FeCl3作电解质溶液。
(3)先通入足量Cl2将Fe2+氧化成Fe3+,Cl2+2Fe2+=2Fe3++2Cl-,再加入CuO来调节溶液的pH至3.2~4.7,使Fe3+转化为Fe(OH)3沉淀,过滤达到除去CuCl2溶液中Fe3+和Fe2+的目的。
(4)根据题中信息,选两种药品为CuO,浓H2SO4,水。
CuO+H2SO4=CuSO4+H2O
Fe+CuSO4=Cu
本题难度:一般
4、实验题 某研究性学习小组探究铁粉与水蒸气反应后的固体的组成,铁粉与水蒸气反应的化学方程式为?????????。
基于上述反应所得黑色固体粉末,研究性学习小组提出下列假设并欲做实验分析。
假设一:固体全部是Fe3O4
假设二:固体全部是Fe
假设三:固体是????
取铁粉与水蒸气反应后的固体作为样品,进行如下实验探究。
探究1:取少量样品投入硫酸铜稀溶液中,若现象为?????,则假设一成立。
探究2:取1.68g样品在纯氧中灼烧后,若质量为???g,则假设二成立。
经过实验探究,假设一、二都不成立。
探究3:取样品4.00g进行如下实验。
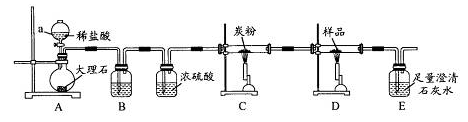
B中的溶液是??????;实验后经测定样品完全反应,D中剩余固体质量为3.36g,且测得E中沉淀质量为6.0g,则样品中Fe3O4的质量分数为??????;实验装置中有一明显缺陷是??????。
参考答案:
3Fe+4H2O(g)  本题解析: 本题解析:
试题分析:
本题是一道探究性的实验题。铁粉与水蒸气反应的化学方程式为3Fe+4H2O(g)  Fe3O4+4H2 Fe3O4+4H2
上述反应如果铁粉全反应完,那么固体就是Fe3O4,如果铁粉一点都没反应,那就是Fe,当然还有铁粉部分反应,还剩余一部分。得到的是Fe3O4和Fe的混合物。为了验证三种假设,做了以下
本题难度:一般
5、选择题 向某晶体的水溶液中加入Fe2+的溶液后,无明显变化,当滴加几滴溴水后,混合液出现血红色。那么,由此得出下列的结论错误的是??????(???)
A.该晶体中一定含有SCN-
B.Fe3+的氧化性比Br2的氧化性强
C.Fe2+被Br2氧化为Fe3+
D.Fe2+与SCN-不能形成血红色的化合物
参考答案:B
本题解析:略
本题难度:一般
|