微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某些高档点心的包装盒内有个小纸袋,小纸袋内装有灰黑色粉末,其中有些已变成棕褐色,将灰黑色粉末溶于盐酸,取上层清液滴入几滴氯水,在滴入KSCN溶液,马上出现血红色,以下结论不正确的是
A.该灰黑色粉末用做抗氧化剂
B.小纸袋内可能装有活性铁粉
C.小纸袋内的原装粉末可能是Fe2O3
D.该灰黑色粉末不可食用
2、选择题 把足量的铁粉投入到溶解有硫酸和硫酸铜的溶液中,充分反应后,剩余金属粉末的质量与原加入铁粉的质量相等,则原溶液中H+与SO42-的物质的量浓度之比为
A.1:4
B.2:7
C.1:2
D.3:8
3、填空题 以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等。实验室模拟工业以硫酸渣制备铁红(Fe2O3),过程如下:
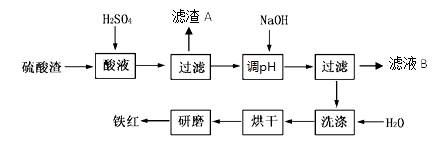
(1)硫酸渣的成分中属于两性氧化物的是???????,写出酸溶过程Fe2O3与稀硫酸反应的离子反应方程式????????????????;
(2)生产过程中,为了确保铁红的纯度,氧化过程需要调节溶液的pH的范围是???????????(部分阳离子以氢氧化物形式沉淀时溶液的pH见下表)
沉淀物
| Fe(OH)3
| Al(OH)3
| Fe(OH)2
| Mg(OH)2
|
开始沉淀
| 2.7
| 3.8
| 7.5
| 9.4
|
完全沉淀
| 3.2
| 5.2
| 9.7
| 12.4
?
(3)滤渣A的主要成分为??????,滤液B可以回收的物质有____________;
(4)简述洗涤过程的实验操作????????????????????????????????????;
(5)已知硫酸渣质量为w kg,假设铁红制备过程中,铁元素损耗25%,最终得到铁红的质量为m kg,则原来硫酸渣中铁元素质量分数为????????(用最简分数表达式表示)。
4、实验题 (10分)实验室可以用下图装置进行CO还原赤铁矿(主要成分为Fe2O3)并测定其中铁的含量的实验(假设杂质不参与反应)。请回答下列问题:
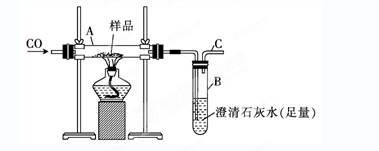
(1)该实验中炼铁的方法是________(填字母)。
A.热分解法
B.热还原法
C.电解法
D.湿法冶金
(2)实验开始后,B中的现象是____________________,A中反应的化学方程式是________________________________________________________。
(3)写出铝和Fe2O3?反应的化学方程式????????????????????????演示实验引发该反应的方法是????????????????????????????????????????????????????????????????????????
(4)若样品的质量为3.6 g,通入足量的CO充分反应后,B增重2.64 g,则样品中铁的质量分数为_____??????_?? (结果保留一位小数)。
5、计算题 用铜和浓硫酸反应,得到SO2的体积为2.24L(标准状况)。
(1)试计算被还原的硫酸的物质的量。
(2)将得到的CuSO4溶液加水配成500ml溶液,则500mlCuSO4溶液中CuSO4的的物质的量浓度是多少?
|