微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 依据氧化还原反应:2Ag+(aq) + Cu(s) == Cu2+(aq) + 2Ag(s)设计的原电池如图。 请回答下列问题

(1)电极X的材料是___________;电解质溶液Y是_____________;
(2)银电极为电池的_______极,发生的电极反应为_____________________; X电极上发生的电极反应为_________________;
(3)外电路中的电子是从____________电极流向___________电极。
参考答案:(1)Cu;AgNO3
(2)正极;Ag++e-==A
本题解析:
本题难度:一般
2、选择题 氢氧燃料电池是一种高效、环境友好的发电装置,它是以铂作电极,KOH溶液作电解液,总反应为:2H2 + O2 = 2H2O,正极反应为:O2 + 2H2O + 4e- = 4OH-下列叙述不正确的是( )
A.H2通入负极区
B.O2通入正极区
C.负极发生氧化反应
D.正极发生氧化反应
参考答案:D
本题解析:
试题分析:A、氢氧燃料电池中燃料发生氧化反应,所以在电池的负极区通入,正确;B、氧气发生还原反应,所以在正极区通入,正确;C、电池中的负极发生氧化反应,正确;D、正极发生还原反应,错误,答案选D。
本题难度:一般
3、选择题 观察下列几个装置示意图,有关叙述错误的是(????)
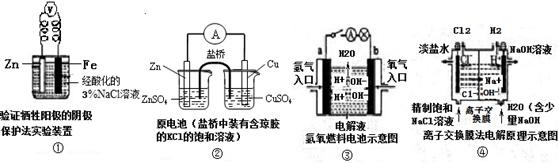
A.装置①中烧杯内中加入黄色的K3[Fe(CN)6]溶液,一段时间后看不到Fe电极附近有蓝色沉淀生成,该装置可看作金属的析氢腐蚀
B.装置②盐桥中的Cl—向硫酸铜溶液移动
C.装置③中外电路电流方向:b极 →a极
D.装置④中阳极反应:2 Cl——2e- = Cl2 ↑
参考答案:B
本题解析:
试题分析:A、装置①是原电池装置,锌作负极,铁作正极,亚铁离子遇到K3[Fe(CN)6]溶液有蓝色沉淀生成,看不到现象说明铁没有被氧化,电解质溶液显酸性,因此发生析氢腐蚀,正确;B、装置②是双液电池,锌作负极,铜作正极,盐桥中阴离子移向负极,向左移,错误;C、装置③是燃料电池,氢气作负极,氧气作正极,电流从正极流向负极,正确;D、装置④是电解池,阳极阴离子失电子发生氧化反应,正确。
本题难度:一般
4、选择题 美国海军海底战事中心与麻省理工大学共同研制成功了用于潜航器的镁—过氧化氢燃料电池系统。其工作原理如图所示。以下说法中错误的是?????????????
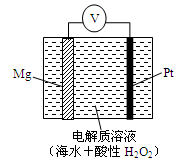
A.电池的负极反应为:Mg – 2e-= Mg2+
B.电池的正极产生的还原产物是水
C.电池工作时,H+向负极移动
D.电池工作一段时间后,溶液的pH增大
参考答案:C
本题解析:
试题分析:A.该燃料电池中,镁作负极,负极上镁失电子发生氧化反应,电极反应式为:Mg-2e-=Mg2+,正确;B.铂作正极,正极上双氧水得电子发生还原反应而生成水,正确;C.原电池放电时,电解质溶液中阳离子向正极移动,所以氢离子向正极移动,错误;D.原电池正极上双氧水得电子结合H+生成水,溶液中氢离子浓度降低,所以溶液的pH增大,正确,答案选C。
本题难度:一般
5、选择题 利用反应:2Ag(aq)+Fe(s)=Fe2+(aq)+2Ag(s)设计原电池并用它作电源进行电解的装置如图所示.NaCl溶液的体积为200mL,假设反应产生的气体全部放出,且反应前后溶液体积的变化忽略不计.下列有关叙述错误的是( )
A.电极A应该用Fe作材料,B是AgNO3溶液,电极C周围溶液变红
B.A、C两极都发生氧化反应,C电极反应式为:2H++2e-=H2↑
C.银电极变粗,为电源的正极,A电极反应式为:Fe-2e-=Fe2+
D.当析出Ag21.6g时 ,NaCl溶液的pH是反应前的2倍
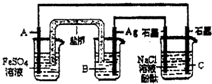
参考答案:A、正极是Ag作材料,则电极A用铁作负极,电解质溶液为AgN
本题解析:
本题难度:简单