微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (15分)【化学——选修3:物质结构与性质】
Ⅰ.顺铂是美国教授B Rosenberg等人于1969年发现的第一种具有抗癌活性的金属配合物,它的化学式为Pt(NH3)2Cl2。
(1)与氮元素处于同一周期且相邻的两种元素分别是????????????,这三种元素的第一电离能由大到小的顺序是?????????,电负性由小到大的顺序是????????????。
(2)与NH3互为等电子体的分子、离子有?????????、????????(各举一例)。
(3)碳铂是1,1-环丁二羧酸二氨合铂(Ⅱ)的简称,是第二代铂族抗癌药物,其毒副作用低于顺铂。碳铂的结构如图:
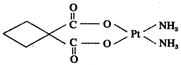
碳铂分子中含有的作用力有???????(填字母)。
A.极性共价键
B.非极性共价键
C.配位键
D.离子键
E.金属键?????? F.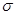 键??????????? G.
键??????????? G.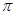 键
键
(4)碳铂中C原子的杂化方式有?????????。
(5)铂(Pt)单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。

晶胞中铂(Pt)原子的配位数为???????。若已知铂(Pt)的摩尔质量为M g/mol,阿伏加德罗常数为NA,Pt原子半径为b pm,则该晶胞的密度为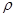 =??????g/cm3。(用含M、NA、b的计算式表示,不用化简)。
=??????g/cm3。(用含M、NA、b的计算式表示,不用化简)。
Ⅱ.原子序数小于36的元素A和B,在周期表中既处于同一周期又位于同一族,且原子序数B比A多1,基态B原子中含有三个未成对电子,B元素在周期表中的位置为????????,A2+在基态时外围电子(价电子)占据的能层符号为???????,外围电子(价电子)排布式?????????。
参考答案:(15分)(1)C、O(1分) N>O>C(1分
本题解析:
试题分析:(1)与氮元素处于同一周期且相邻的两种元素分别是C、O,第一电离能随核电荷数的增加而增大,但N原子的2p轨道为半充满状态,是稳定状态,所以第一电离能最大,因此这三种元素的第一电离能从大到小的顺序是N>O>C,电负性随核电荷数的增加而增大,所以这三种元素的电负性由小到大的顺序是C<N<O;
(2)等电子体是指价电子和原子总数都相同的微粒,NH3是4原子、8个价电子的分子,所以与NH3互为等电子体的分子、离子有PH3、H3O+或CH3-
(3)根据碳铂分子
本题难度:一般
2、填空题 已知:①A的简单阴离子核外有2个电子,B元素原子最外层电子数是内层电子数的3倍,E原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于分子晶体,F元素原子序数为26。
②X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表:
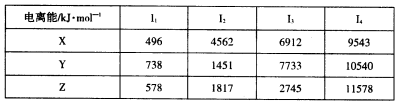
回答下列问题:
(1)B元素原子核外已成对电子数是未成对电子数的____倍。
(2)X、Y、Z的电负性从大到小的顺序为____(用元素符号表示)。
(3)分子式为A2B、A2E的两种物质中???__更稳定(用化学式表示),原因是____。
(4)X的氯化物的熔点比Y的氯化物的熔点____,原因是____。
(5)F的氯化物FCl3与KSCN溶液反应显红色,该反应的离子方程式为____。等电子体指的是原子总数相同.价电子总数相同的分子.离子或基团,据此定义写出离子SCN—的一种等电子体____。
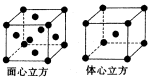
(6)F的一种常见配合物F(CO)3常温下呈液态,熔点为- 20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断F(CO)5的晶体类型为????。F元素的单质晶体在不同温度下有两种堆积方式,晶胞分别如
图所示。在面心立方晶胞中F原子的配位数为____,体心立方晶胞的密度可表示为____。(F的原子半径为r)
参考答案:
 本题解析:
本题解析:
试题分析:依题意可知:A为H,B为O,E为S,F为Fe,X的第一电离能小容易失去一个电子,所以为Na,Y的第三电离能突然增大,表明Y为Mg,同事Z为Al。
(6)小题中的物质溶沸点低,易溶于有机溶剂,所以为分子晶体。
由分摊法计算: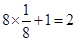 ;该晶胞的质量m=
;该晶胞的质量m= 本题难度:一般
本题难度:一般
3、填空题 有①、②、③、④、⑤、⑥、⑦、⑧、⑨、⑩十种元素,原子序数依次增大,⑨、⑩处于第四周期,其余均为短周期元素.
(1)若②、⑦、⑧三种元素在周期表中相对位置如下:
| ② | | |
⑦
⑧
②与⑦、②与⑧形成的液体化合物是常见的重要溶剂,则②、⑦、⑧三种元素最高价氧化物对应的水化物酸性由强到弱的顺序是:______(用化学式表示).
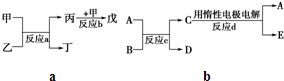
(2)若甲、乙、丙、丁、戊均为上述八种短周期元素中的某些元素组成的单质或由其中两种元素组成的化合物,且甲、戊为无色气体,反应a为置换反应,反应b为化合反应.如图所示转化关系,推测:戊可能为:______、______(列举合适的两例).
若甲是O2、乙是N2H4,反应a是在强碱性溶液中进行的原电池反应,则负极发生的电极反应式为:______.
(3)若图中A、B、C、D、E分别是上述10种元素中的某些元素组成的单质或其中两种元素组成的化合物.已知:A是常见的金属单质,反应c为置换反应.若反应c是用A作电极,在B的水溶液中进行电解反应,它们有如右图示转化关系.则反应d中阴极的电极反应式为:______.
若反应c是在高温下进行的,且为工业上有重要应用价值的放热反应,当物质C是一种两性化合物时,则反应c的化学方程式为:______.
参考答案:(1)因②与⑦、②与⑧形成的液体化合物是常见的重要溶剂,结合
本题解析:
本题难度:简单
4、填空题 硼元素在化学中有很重要的地位,硼及其化合物广泛应用于永磁材料、超导材料、富燃料材料、复合材料等高新材料领域。
(1)三氟化硼在常温常压下为具有刺鼻恶臭和强刺激性的无色有毒腐蚀性气体,其分子的立体构型为________,B原子的杂化类型为________。
(2)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层。图(a)是磷化硼晶体的晶胞示意图,则磷化硼的化学式为________,该晶体的晶体类型是________。
(3)正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子间通过氢键相连[如图(b)]。
①硼酸分子中B最外层有________个电子,1 mol H3BO3的晶体中有________mol氢键。
②硼酸溶于水生成弱电解质一水合硼酸B(OH)3·H2O,它电离生成少量[B(OH)4]-和H+离子。则硼酸为________元酸,[B(OH)4]-含有的化学键类型为________。

参考答案:(1)平面三角形 sp2
(2)BP 原子晶体
本题解析:(1)BF3分子中,B原子形成了3个σ键,不含孤电子对,故杂化轨道数为3,杂化方式为sp2杂化,BF3分子立体构型为平面三角形。(2)一个晶胞中含有B原子的个数为8×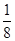 +6× +6×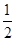
本题难度:一般
5、选择题 关于Na元素和F元素的叙述正确的是( )
A.原子半径Na<F
B.原子序数Na>F
C.原子的电子层数Na<F
D.原子最外层电子数Na>F
参考答案:B
本题解析:
本题难度:一般
|