微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 (13分)工业上用重晶石(BaSO4)制备其他钡盐的常用方法主要有高温煅烧还原法、沉淀转化法等。
I.高温煅烧还原法
工业上利用重晶石高温煅烧还原法制备BaCl2的工艺流程图如下:
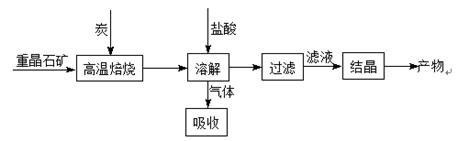
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得:
BaSO4(s) + 4C(s)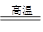 4CO(g) + BaS(s) △H1 =" +" 571.2 kJ·mol-1 ①
4CO(g) + BaS(s) △H1 =" +" 571.2 kJ·mol-1 ①
BaSO4(s) + 2C(s)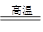 2CO2(g) + BaS(s) △H2 =" +" 226.2 kJ·mol-1 ②
2CO2(g) + BaS(s) △H2 =" +" 226.2 kJ·mol-1 ②
(1)气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为: 。
(2)反应C(s) + CO2(g)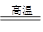 2CO(g)的△H= kJ·mol-1。
2CO(g)的△H= kJ·mol-1。
(3)实际生产中必须加入过量的炭,同时还要通入空气,其目的可能是 。
II.沉淀转化法
(4)已知KSP(BaSO4) =1.0×10-10,KSP(BaCO3)=2.5×10-9。某同学设想用饱和Na2CO3溶液和盐酸将BaSO4转化成BaCl2,若用10 L Na2CO3溶液一次性溶解并完全转化1.0 mol BaSO4(溶液体积变化可忽略不计), 则该转化过程的离子方程式为 ; 反应的平衡常数K= ;Na2CO3溶液的最初浓度不得低于 。
参考答案:(1)S2- + H2O  本题解析:
本题解析:
试题分析:(1)硫化钠是强碱弱酸盐,硫离子水解,方程式为S2- + H2O  HS- +OH-。
HS- +OH-。
(2)已知BaSO4(s) + 4C(s)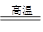 4CO(g) + BaS(s) △H1=+ 571.2 kJ·mol-1 ①,BaSO4(s) + 2C(s)
4CO(g) + BaS(s) △H1=+ 571.2 kJ·mol-1 ①,BaSO4(s) + 2C(s)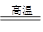 2CO2(g) + BaS(s) △H2 =" +" 226.2 kJ·mol-1 ②,则根据盖斯定律可知(①—②)÷2即可得到反应C(s) + CO2(g)
2CO2(g) + BaS(s) △H2 =" +" 226.2 kJ·mol-1 ②,则根据盖斯定律可知(①—②)÷2即可得到反应C(s) + CO2(g)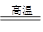 2CO(g)的△H=+ 172.5kJ·mol-1。
2CO(g)的△H=+ 172.5kJ·mol-1。
(3)过量的碳能使BaSO4得到充分的还原(或提高BaS的产量);同时①②为吸热反应,炭和氧气反应放热可以维持反应所需高温,所以实际生产中必须加入过量的炭,同时还要通入空气。
(4)饱和Na2CO3溶液和BaSO4反应的离子方程式为BaSO4(s) + CO32-(aq) BaCO3(s) + SO42-;反应的平衡常数K=
BaCO3(s) + SO42-;反应的平衡常数K=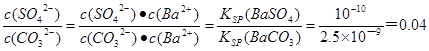 。当完全转化后溶液中硫酸根的浓度是1mol÷10L=0.1mol/L,所以溶液中碳酸根的浓度是0.1mol/L÷0.04=2.5mol/L。生成1mol碳酸钡消耗1mol碳酸钠,所以碳酸钠的起始浓度不低于
。当完全转化后溶液中硫酸根的浓度是1mol÷10L=0.1mol/L,所以溶液中碳酸根的浓度是0.1mol/L÷0.04=2.5mol/L。生成1mol碳酸钡消耗1mol碳酸钠,所以碳酸钠的起始浓度不低于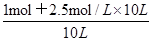 =2.6mol/L。
=2.6mol/L。
考点:考查物质制备工艺流程图的分析以及溶解平衡的应用
本题难度:困难
2、填空题 (1)25℃时,pH=12.0的KOH溶液中,由水电离出的C(OH-)=_______mol/L;pH=12.0的K2CO3溶液中,由水电离出来的C(OH-)=_______mol/L。
(2)常温下0.1mol·L-1 CH3COONa溶液PH=8
①用离子方程式表示CH3COONa溶液PH=8的原因:
②按物质的量浓度由大到小顺序排列该溶液中各种微粒(水分子除外)
(3)FeCl3的水溶液呈 (填“酸”、“中”、“碱”)性,原因是(用离子方程式表示): , 实验室在配制FeCl3的溶液时,常将FeCl 3固体先溶于 中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解,否则得到的是浑浊的溶液。
参考答案:(1)1×10-12 &#
本题解析:
试题分析:(1)抑制水电离,含有弱根离子的盐促进水电离,碱溶液中水电离出的c(OH-)=c(H+)=10-12 mol/L,K2CO3是强碱弱酸盐,促进水电离,溶液中水电离出的c(OH-) 为水的离子积常数与c(H+)的比,所以水电离出来的c(OH-)=10?14/10?12mol/L=10-2 mol/L。(2)①醋酸钠中醋酸根离子能水解,导致溶液显示碱性,即CH3COO-+H2O CH3COOH+OH- ,②按物质的量浓度由大到小顺序排列该溶液中各种微粒为:c(Na+)>c(CH3COO-)>c(H+)>c(OH-);(3)FeCl3的水溶液中,由于三价铁离子的水解,导致溶液呈酸性,Fe3++3H2O
CH3COOH+OH- ,②按物质的量浓度由大到小顺序排列该溶液中各种微粒为:c(Na+)>c(CH3COO-)>c(H+)>c(OH-);(3)FeCl3的水溶液中,由于三价铁离子的水解,导致溶液呈酸性,Fe3++3H2O  Fe(OH)3+3H+ ,将FeCl3固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,这样盐酸可以抑制三价铁离子水解;
Fe(OH)3+3H+ ,将FeCl3固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,这样盐酸可以抑制三价铁离子水解;
考点:离子积常数;溶液pH的定义;铁的化学性质。
本题难度:困难
3、填空题 (14分)A、B、C、D为原子序数依次增大的四种第三周期元素,其单质及其化合物的性质或结构信息如下表所述。
元素
| A
| B
| C
| D
|
性质
结构
信息
| 工业上常用电解熔融AD2制取A的单质。
| B的最外层电子数比最内层电子数多1。
| C的最高价氧化物的水化物经聚合、脱水,可作袋装食品干燥剂。
| D的一种气态氧化物甲对空气的相对密度为3,它溶于水得到单一溶质的弱酸性溶液(有漂白性),该溶液光照后酸性增强。
请按要求回答下列问题:
(1)工业上制取A的单质的化学方程式: 。
(2)在25oC、10l kPa下,已知13.5g的B的固体单质在D的气体单质中完全燃烧后恢复至原状态,放热419 kJ,该反应的热化学方程式是 。
(3)Sn与元素C同主族,周期数比元素C的大2.则Sn的原子序数为 ;配制SnCl2溶液时需用盐酸溶解其晶体,其目的是 。
(4)甲中各原子都满足8电子稳定结构,其电子式为 ;甲溶于水后光照一段时间溶液酸性增强的原因(用离子方程式表示) 。
(5)将A的单质、B的单质棒用导线连接后插入稀NaOH溶液中。写出负极反应的电极方程式 。
参考答案:(1)MgCl2(熔融)电解Mg+Cl2↑ (
本题解析:
试题分析:A、B、C、D为原子序数依次增大的四种第三周期元素,工业上常用电解熔融AD2制取A的单质,说明A应该是活泼的金属镁。B的最外层电子数比最内层电子数多1,因此B的原子序数是13,是铝元素。C的最高价氧化物的水化物经聚合、脱水,可作袋装食品干燥剂,则C是硅元素。D的一种气态氧化物甲对空气的相对密度为3,它溶于水得到单一溶质的弱酸性溶液(有漂白性),该溶液光照后酸性增强,该弱酸性物质应该是次氯酸,即D是氯元素。甲的相对分子质量是3×29=87,所以甲是Cl2O。
(1)工业上电解熔融的氯化镁冶炼单质镁,反应的化学方程式为MgCl2(熔融)电解Mg+Cl2↑。
(2)13.5g的铝的物质的量是13.5g÷27g/mol=0.5mol,完全与氯气反应放出419 kJ的热量,因此2mol完全反应放出的热量是419 kJ×4=1676kJ,则反应的热化学方程式为2Al(s)+3Cl2(g)=2AlCl3(s) △H=-1676kJ/mol。
(3)Sn与元素硅同主族,周期数比元素硅的大2.则Sn的原子序数为14+18+18=50;+2价的锡在溶液中易水解,因此配制SnCl2溶液时需用盐酸溶解其晶体的目的是抑制SnCl2水解。
(4)甲中各原子都满足8电子稳定结构,这说明氧元素形成2对共用电子对,因此其电子式为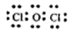 ;次氯酸不稳定,见光易分解生成氯化氢和氧气,所以溶液的酸性增强,反应的用离子方程式为2HClO光照2H++2Cl-+O2↑。 ;次氯酸不稳定,见光易分解生成氯化氢和氧气,所以溶液的酸性增强,反应的用离子方程式为2HClO光照2H++2Cl-+O2↑。
(5)镁的金属性强于铝,但与氢氧化钠溶液反应的是铝,而不是镁,所以将A的单质、B的单质棒用导线连接后插入稀NaOH溶液中镁是正极,铝是负极,负极反应的电极方程式为Al-3e-+4OH-=AlO2-+2H2O。
考点:考查元素推断、金属冶炼、热化学方程式、元素周期表的结构、电子式、次氯酸以及原电池原理等
本题难度:困难
4、选择题 下列说法正确的是( )
A.在Na2CO3、NaHCO3两溶液中,离子种类不相同
B.在等体积、等物质的量浓度的Na2CO3、NaHCO3两溶液中,阳离子总数相等
C.在NaHCO3和Na2CO3混合溶液中一定有:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-)
D.在NaHCO3和Na2CO3混合溶液中一定有:2c(Na+)=3[c(HCO3-)+c(CO32-)+c(H2CO3)]
参考答案:C
本题解析:
试题分析:A.在Na2CO3中含有Na+、CO32-、HCO3-、H+、OH-,在NaHCO3中含有Na+、CO32-、HCO3-、H+、OH-。离子种类相同。错误。B.等体积、等物质的量浓度的Na2CO3、NaHCO3两溶液即n(Na2CO3)= n(NaHCO3),Na2CO3=2Na++ CO32-, NaHCO3= HCO3- +Na+.二者的水溶液水解都显碱性。所以阳离子总数Na2CO3> NaHCO3。错误。C.在任何溶液中都存在电荷守恒。即阳离子所带的正电荷总数与阴离子所带的负电荷总数相等。正确。D.根据物料电荷守恒可得对于Na2CO3来说c(Na+)=2c(CO32-)(始)=
2c(HCO3-)+2c(H2CO3)+2c(CO32-)。对于NaHCO3来说c(Na+)=c(HCO3-)(始)= c(HCO3-)+c(H2CO3)+c(CO32-)。在NaHCO3和Na2CO3混合溶液中二者的浓度比为2:1时Na+的浓度相等。将上述两式相加有:2c(Na+)=3[c(HCO3-)+c(CO32-)+c(H2CO3)]。若物质的量之比不是2:1,则不能相加,即上述式子不成立。错误。
考点:考查Na2CO3、NaHCO3溶液或混合溶液中离子的种类、个数及符合的关系的知识。
本题难度:困难
5、填空题 (16分)物质在水溶液中可能存在电离平衡、盐的水解平衡
(1)有0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序为
。
(2)有0.1 mol·L-1的NaHCO3溶液,在该溶液中存在的平衡有三个,请分别用离子方程式表示:
_________________
。
(3)NH3·H2O 的电离方程式是 ,往氨水中加入少量醋酸铵固体(提示醋酸铵呈中性),C(OH-) (填“增大”“减小”“不变”)。
(4)已知某温度下K(NH3·H2O)=1.69×10-5,则该温度下0.1mol/L的氨水中C(OH-)= mol/L
(5)若将等pH、等体积的②NaOH溶液和⑦NH3·H2O溶液分别加水稀释m倍、n倍,稀释后两种溶液的pH仍相等,则m________(填“<”、“>”或“=”)n。
参考答案:(1)c(NH4+)>c(SO42-)>c(H+)>c(OH
本题解析:
试题分析:(1) (NH4)2SO4水解,溶液呈酸性,所以c(NH4+)>c(SO42-)>c(H+)>c(OH-);(2)NaHCO3溶液中,存在HCO3-的水解,HCO3-+H2O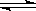 H2CO3+OH-;HCO3-的电离,)HCO3- H2CO3+OH-;HCO3-的电离,)HCO3-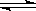 H+ +CO32-;水的电离H20 H+ +CO32-;水的电离H20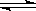 H+ +OH-;(3)NH3·H2O 为弱电解质,电离方程式是NH3.H2O H+ +OH-;(3)NH3·H2O 为弱电解质,电离方程式是NH3.H2O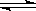 NH4+ + OH-;铵根离子浓度增大,NH3.H2O NH4+ + OH-;铵根离子浓度增大,NH3.H2O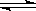 NH4+ + OH-电离平衡左移,c(OH-)减小;(4) K(NH3·H2O)=1.69×10-5,所以 NH4+ + OH-电离平衡左移,c(OH-)减小;(4) K(NH3·H2O)=1.69×10-5,所以 ,所以c(OH-)=1.3×10-3mol/L;(5)弱电解质稀释相同倍数,PH变化小,故m<n。 ,所以c(OH-)=1.3×10-3mol/L;(5)弱电解质稀释相同倍数,PH变化小,故m<n。
考点:本题考查弱电解质电离和盐的水解。
本题难度:困难
|