微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知氢氟酸酸性强于氢氰酸(HCN),下列判断正确的是
A.NaCN 与 HCN 的混合液中一定有C(Na+)>C(CN-)>C(OH-)>C(H+)
B.氢氟酸溶液的导电性一定强于氢氰酸
C.相同温度下,同浓度、同体积的NaF溶液和NaCN溶液,离子数目前者大于后者
D.氢氟酸能与Na2C03反应生成C02气体,HCN也一定能与Na2CO3反应生成C02气体
参考答案:C
本题解析:
试题分析:A. NaCN 与 HCN 的混合液中存在CN-的水解过程,水解导致溶液显碱性,还存在HCN的电离过程,电离使溶液显酸性,无法确定该溶液的酸碱性,A项错误;B.溶液的导电性取决于溶液中离子浓度的大小,该溶液浓度未定,无法确定溶液的导电性,B项错误;C.同体积、同浓度,离子数目之比等于离子浓度之比,根据电荷守恒,NaF溶液中,C(Na+)+ C(H+)=C(F-)+C(OH-),离子浓度等于2[C(Na+)+ C(H+)],同理在NaCN溶液中,离子浓度等于2[C(Na+)+ C(H+)],两溶液中离子数目的差别在于水电离出来的H+的不同,由于HCN比HF更难电离,CN-的水解程度比F-的大,NaCN溶液中OH-离子浓度要大些,溶液中由水电离出来的H+离子浓度小,所以相同温度下,同浓度、同体积的NaF溶液和NaCN溶液,离子数目前者大于后者,C项正确;D.根据强酸制弱酸的原理,氢氟酸酸性强于氢氰酸(HCN),氢氟酸能与Na2C03反应生成C02气体,HCN不一定能与Na2CO3反应生成C02气体,D项错误;选C。
考点:考查电解质溶液中离子浓度的大小比较。
本题难度:一般
2、填空题 (7分)NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,
用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题:
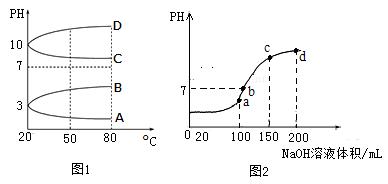
(1)相同条件下,相等物质的量浓度的NH4Al(SO4)2中c(NH4+) (填“=”、“>”“<”)NH4HSO4中c(NH4+)。
(2)如图1是0.1mol?L
参考答案:
本题解析:
本题难度:困难
3、选择题 归纳法是
参考答案:
本题解析:
本题难度:困难
4、选择题 下列离子方程式中,属于水解反应的是
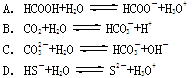
参考答案:C
本题解析:
试题分析:A.为醋酸的电离方程式,故不选A;B.为碳酸的电离方程式。故不选B;C.为碳酸根离子的水解,故选C;D.为硫氢根离子的电离方程式,故不选D。
考点:水解反应的离子方程式和电离方程式的判断。
本题难度:一般
5、选择题 下列溶液中微粒的物质的量浓度关系正确的是
A.25℃时,pH=7的NH4Cl与NH3·H2O混合溶液:c(H+)= c(OH-)= c(NH4++)=c(Cl-)
B.0.1mol/LNa2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S)
C.25℃时,pH=2的HCOOH与pH=12的NaOH等体积混合:c(HCOO-)+ c(H+)>c(Na+)+c(OH-)
D.0.1mol/LNa2CO3溶液与0.1mol/L NaHCO3溶液等体积混合:2c(CO32-)+2c(HCO3-)+2c(H2CO3)=3c(Na+)
参考答案:CD
本题解析:
试题分析:A、25℃时,pH=7的NH4Cl与NH3·H2O混合溶液呈中性,则有c(H+)=c(OH-),由电荷守恒式:c(H+)+ c(NH4+)= c(OH-)+ c(Cl-)知c(NH4+)=c(Cl-),又弱电解质的电离和盐类的水解是微弱的则c(NH4+)=c(Cl-)> c(H+)=c(OH-),错误;B、0.1mol/LNa2S溶液中,根据质子守恒知c(OH-)=c(H+)+c(HS-)+2c(H2S),错误;C、25℃时,pH=2的HCOOH与pH=12的NaOH溶液中,c(HCOOH)>c(NaOH),等体积混合后HCOOH远过量,溶液为HCOOH和CH3COONa,呈酸性,结合电荷守恒式知c(HCOO-)+c(H+)>c(Na+)+c(OH-),正确;D、根据物料守恒得2c(CO32-)+2c(HCO3-)+2c(H2CO3)=3(Na+),正确。
考点:考查溶液中离子浓度的大小关系及守恒规律的应用。
本题难度:困难