微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (16分)物质在水溶液中可能存在电离平衡、盐的水解平衡
(1)有0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序为
。
(2)有0.1 mol·L-1的NaHCO3溶液,在该溶液中存在的平衡有三个,请分别用离子方程式表示:
_________________
。
(3)NH3·H2O 的电离方程式是 ,往氨水中加入少量醋酸铵固体(提示醋酸铵呈中性),C(OH-) (填“增大”“减小”“不变”)。
(4)已知某温度下K(NH3·H2O)=1.69×10-5,则该温度下0.1mol/L的氨水中C(OH-)= mol/L
(5)若将等pH、等体积的②NaOH溶液和⑦NH3·H2O溶液分别加水稀释m倍、n倍,稀释后两种溶液的pH仍相等,则m________(填“<”、“>”或“=”)n。
参考答案:(1)c(NH4+)>c(SO42-)>c(H+)>c(OH
本题解析:
试题分析:(1) (NH4)2SO4水解,溶液呈酸性,所以c(NH4+)>c(SO42-)>c(H+)>c(OH-);(2)NaHCO3溶液中,存在HCO3-的水解,HCO3-+H2O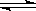 H2CO3+OH-;HCO3-的电离,)HCO3-
H2CO3+OH-;HCO3-的电离,)HCO3-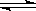 H+ +CO32-;水的电离H20
H+ +CO32-;水的电离H20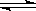 H+ +OH-;(3)NH3·H2O 为弱电解质,电离方程式是NH3.H2O
H+ +OH-;(3)NH3·H2O 为弱电解质,电离方程式是NH3.H2O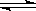 NH4+ + OH-;铵根离子浓度增大,NH3.H2O
NH4+ + OH-;铵根离子浓度增大,NH3.H2O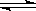 NH4+ + OH-电离平衡左移,c(OH-)减小;(4) K(NH3·H2O)=1.69×10-5,所以
NH4+ + OH-电离平衡左移,c(OH-)减小;(4) K(NH3·H2O)=1.69×10-5,所以 ,所以c(OH-)=1.3×10-3mol/L;(5)弱电解质稀释相同倍数,PH变化小,故m<n。
,所以c(OH-)=1.3×10-3mol/L;(5)弱电解质稀释相同倍数,PH变化小,故m<n。
考点:本题考查弱电解质电离和盐的水解。
本题难度:困难
2、填空题 工业制硫酸的过程中利用反应2SO2(g)+O2(g) 2SO3(g)+Q (Q>0),将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
2SO3(g)+Q (Q>0),将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
(1)写出该可逆反应的化学平衡常数表达式 ;
(2)一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2发生反应,下列说法中,正确的是 (填编号)。
a.若反应速率υ正(O2)=2υ逆(SO3),则可以说明该可逆反应已达到平衡状态
b.保持温度和容器体积不变,充入2 mol N2,化学反应速率加快
c.平衡后移动活塞压缩气体,平衡时SO2、O2的百分含量减小,SO3的百分含量增大
d.平衡后升高温度,平衡常数K增大
将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
实验编号
| 温度/℃
| 起始量/mol
| 平衡量/mol
| 达到平衡所需时间/min
|
SO2
| O2
| SO2
| O2
|
1
| T1
| 4
| 2
| x
| 0.8
| 6
|
2
| T2
| 4
| 2
| 0.4
| y
| t
(3)实验1从开始到反应达到化学平衡时,υ(SO2)表示的反应速率为 ;
T1 T2 (选填“>”、“<”或“=”),理由是 。尾气SO2用NaOH溶液吸收后会生成Na2SO3。现有常温下0.1mol/LNa2SO3溶液,实验测定其pH约为8,完成下列问题:
(4)该溶液中c(Na+)与 c(OH-)之比为 。
该溶液中c(OH—)= c(H+)+ + (用溶液中所含微粒的浓度表示)。
(5)如果用含等物质的量溶质的下列各溶液分别来吸收SO2,则理论吸收量由多到少的顺序是 (用编号排序)
A.Na2SO3 B.Ba(NO3)2 C.Na2S D.酸性KMnO4
参考答案:(1)K=[SO3]2/([SO2]2[O2])
(2
本题解析:
试题分析:(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,因此根据方程式可知其平衡常数表达式为K=[SO3]2/([SO2]2[O2])。
(2)a、反应速率υ正(O2)=2υ逆(SO3)不能满足反应速率之比是相应的化学计量数之比,因此不能说明该可逆反应已达到平衡状态,a不正确;b、保持温度和容器体积不变,充入2 mol N2,物质的浓度不变,则化学反应速率不变,b不正确;c、平衡后移动活塞压缩气体,压强增大平衡向正反应方向移动,所以平衡时SO2、O2的百分含量减小,SO3的百分含量增大,c正确;D、正方应是放热反应,则平衡后升高温度,平衡向逆反应方向移动,所以平衡常数K减小,d不正确,答案选c。
(3)根据表中数据可知平衡时氧气的物质的量减少2mol-0.8mol=1.2mol,则根据反应式可知生成三氧化硫2.4mol,其浓度为2.4mol÷2=1.2mol/L,所以用三氧化硫表示的反应速率为1.2mol/L÷6min=0.2mol/(L· min)。X=4mol-1.2mol×2=1.6mol,而在t2时二氧化硫的平衡量是0.4mol,这说明t2时二氧化硫的转化率高。由于正方应是放热反应,所以降低温度才有利于SO2的转化,所以T1>T2。
(4)pH约为8,因此溶液中c(OH-)=10-6mol/L,溶液中钠离子浓度为0.2mol/L,所以该溶液中c(Na+)与c(OH-)之比为0.2mol/L ÷10-6mol/L =2×105 。根据质子守恒可知该溶液中c(OH—)=c(H+)+ c(HSO3-)+2c(H2SO3)。
(5)A、Na2CO3吸收二氧化硫发生的反应为:Na2CO3+2SO2+H2O=2NaHSO3+CO2↑,1molNa2CO3最多吸收二氧化硫2mol;B、Ba(NO3)2 吸收二氧化硫反应化学方程式为Ba(NO3)2+3SO2+2H2O=BaSO4↓+2H2SO4+2NO↑:1molBa(NO3)2最多吸收二氧化硫3mol;C、Na2S 吸收二氧化硫发生的反应为:2Na2S+5SO2+2H2O=4NaHSO3+3S↓,1mol2Na2S最多反应二氧化硫2.5mol;D、酸性KMnO4溶液吸收二氧化硫的反应2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+,1molKMnO4最多反应二氧化硫2.5mol;计算分析吸收二氧化硫理论吸收量由多到少的顺序是B>C=D>A,故答案为:B>C=D>A。
考点:考查可逆反应的有关判断、计算以及溶液中离子浓度关系的有关判断与计算
本题难度:困难
3、选择题 下列各溶液中,微粒的物质的量浓度关系正确的是
A.pH=5的NaHSO3溶液中:c(HSO3—)>c(H2SO3)>c(SO32—)
B.使酚酞呈红色的苯酚与苯酚钠混合溶液中:c(Na+)>c(C6H5O-)>c(OH
参考答案:
本题解析:
本题难度:困难
4、填空题 (12分)氮元素可以形成多种氢化物,如NH3、N2H4等。
(1)据报道,2016年中国将发射“天宫二号”空间实验室,并发射“神舟十一号”载人飞船和“天舟一号”货运飞船,与“天宫二号”交会对接。火箭升空需要高能燃料,通常用肼(N2H4)作燃料,N2O4作氧化剂。已知
N2(g)+O2(g)=2NO(g)△H=+180.7kJ?mol-1
2NO(g)+O2(g)=2NO2(g)△H=-113.0kJ?mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ?mol-1
2NO2(g) N2O4(g)△H=-52.7kJ?mol-1 N2O4(g)△H=-52.7kJ?mol-1
写出气态肼在气态四氧化二氮中燃烧生成氨气和气态水的热化学方程式:______________.
(2)工业上以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g),该反应的平衡常数和温度关系如下所示: CO(NH2)2(l)+H2O(g),该反应的平衡常数和温度关系如下所示:
T/℃
| 165
| 175
| 185
| 195
| K
| 111.9
| 74.1
| 50.6
| 34.8
①该反应的△H 0(填“>”或“<”)。
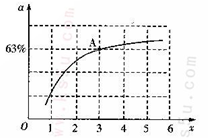
②已知原料气中的氨碳比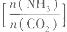 为x,CO2的平衡转化率为a,在一定温度和压强下,a与x的关系如下图所示。a随着x的增大而增大的原因是__________。图中A点处,NH3的平衡转化率为__________。 为x,CO2的平衡转化率为a,在一定温度和压强下,a与x的关系如下图所示。a随着x的增大而增大的原因是__________。图中A点处,NH3的平衡转化率为__________。
(3)①在氢水加水稀释的过程中,NH3·H2O的电离程度____(填“增大”、“减小”或“不 变”,下同),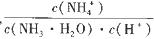 的值__________。 的值__________。
②室温下,amol/L的(NH4)2SO4溶液的pH=5,原因是__________________(用离子方程式表示),该反应的平衡常数为__________(用含a的数学表达式表示)。
参考答案:(1)2N2H4(g)+N2O4(g) 本题解析: 本题解析:
试题分析:(1)由①N2(g)+O2(g)=2NO(g)△H=+180.7kJ?mol-1
②2NO(g)+O2(g)=2NO2(g)△H=-113.0kJ?mol-1
③N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ?mol-1
④2NO2(g) N2O4(g)△H=-52.7kJ?mol-1 N2O4(g)△H=-52.7kJ?mol-1
根据盖斯定律可知?×2-④-?-?得2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g),
△H=(-534.0kJ?mol-1)×2-(-52.7kJ?mol-1)-(180.7kJ?mol-1)-(-113.0kJ?mol-1)=-1083.0 kJ?mol-1,
即热化学方程式为2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1083.0 kJ?mol-1;(2)①随着温度升高,K值减小,正反应方向为放热,ΔH<0;②根据题给图象分析,增大氨气浓度平衡正向进行,从而提高二氧化碳的转化率;A点处x=3,原料气中的NH3和CO2的物质的量之比为3,二氧化碳转化率为63%,假设氨气为3mol,二氧化碳为1mol,则反应的二氧化碳为0.63mol,依据化学方程式
2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(l)反应的氨气为1.26mol,NH3的平衡转化率="1.26mol÷3mol×100%=42%" ;(3)①在氨水加水稀释的过程中,氨水的电离程度增大,电离平衡常数K值只与温度有关,不变;②室温下,amol/L的(NH4)2SO4溶液的pH=5,原因是铵根发生了水解:NH+H2O CO(NH2)2(l)+H2O(l)反应的氨气为1.26mol,NH3的平衡转化率="1.26mol÷3mol×100%=42%" ;(3)①在氨水加水稀释的过程中,氨水的电离程度增大,电离平衡常数K值只与温度有关,不变;②室温下,amol/L的(NH4)2SO4溶液的pH=5,原因是铵根发生了水解:NH+H2O NH3·H2O+H+;该反应的平衡常数为K=C(NH3·H2O)·C(H+)/C(NH4+)= NH3·H2O+H+;该反应的平衡常数为K=C(NH3·H2O)·C(H+)/C(NH4+)=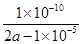
考点:考查盖斯定律、热方程式的书写,化学平衡常数及化学平衡的图像和计算,弱电解质的电离和盐类的水解。
本题难度:困难
5、填空题 下列一句话中叙述了两个值,前者记为M,后者记为N,M和N的关系从A、B、C、D 中选择:
A.M>N B.M<N C. M="N" D. 无法比较
(1)相同温度下,1L 1mol/L 的NH4Cl溶液和2 L 0.5mol·L-1NH4Cl溶液,两溶液中NH4+的个数: ;
(2)相同温度下,pH值为12的烧碱溶液和CH3COONa溶液,两溶液中水的电离程度: ;
(3)常温下两份等浓度的纯碱溶液,将第二份升高温度,两溶液中c(HCO3-): ;
(4)将pH值为2的醋酸和盐酸都稀释相同倍数所得稀溶液的pH值: ;
参考答案:(1)A (2)B (3)B
本题解析:
试题分析:(1)氯化铵中,铵根离子水解,铵根离子浓度越大水解程度越小,即相同温度下,1L 1mol/L 的NH4Cl溶液中的NH4+个数大于2L 0.5mol?L-1NH4Cl溶液中NH4+的个数,故答案为:A;(2)pH值为12的烧碱溶液中水电离出的氢离子浓度为10-12mol/L,pH值为12的CH3COONa溶液中水电离出的氢离子浓度为10-2mool/L,所以相同温度下,pH值为12的烧碱溶液中水的电离度小于pH值为12的CH3COONa溶液中水的电离度,故答案为:B;(3)碳酸钠溶液中,碳酸根的水解程度随着温度的升高而增大,及升高温度以黄埔,碳酸氢根的浓度增大,故答案为:B;(4)醋酸是弱酸,稀释促进电离,盐酸是强酸,稀释过程浓度减小,所以将pH值为2的醋酸和盐酸都稀释相同倍数所得稀溶液的pH值是醋酸的小于盐酸的,故答案为:B;
考点:影响盐类水解程度的主要因素;有关ph的计算
本题难度:一般
|
|