微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 室温,把0.02mol/LCH3COOH溶液和0.01mol/LNaOH溶液以等体积混合,则混合液中微粒浓度关系正确的为
A.c (CH3COO-)>c (Na+)
B.c (OH-)>c (H+)
C.c (CH3COOH)>c (CH3COO-)
D.c (CH3COOH)+c (CH3COO-)=0.02mol/L
参考答案:A
本题解析:
试题分析:A、溶液混合后得到等浓度的醋酸钠和醋酸,溶液显酸性,即氢离子浓度大于氢氧根离子浓度,根据电荷守恒判断,醋酸根离子浓度大于钠离子浓度,选A;B、溶液显酸性,不选B;C、电离大于水解,所以醋酸跟离子浓度大于醋酸分子浓度,不选C;D、溶液混合后溶液的体积增大,所以醋酸分子和醋酸根离子浓度的加和等于0.01 mol/L ,不选D。
考点:酸碱混合后溶液中的离子浓度比较。
本题难度:一般
2、选择题 下列物质溶于水时会破坏水的电离平衡,且属于电解质的是
A.氯气
B.二氧化碳
C.碘化钾
D.醋酸钠
参考答案:D
本题解析:略
本题难度:一般
3、实验题 (11分)用中和滴定法确定某烧碱样品的浓度,试根据实验回答下列问题:
(1)滴定时,用0.2000mol·L-1的盐酸来滴定待测溶液,不可选用 (填编号字母)作指示剂。
(A)甲基橙 (B)石蕊 (C)酚酞
(2)若选用甲基橙作指示剂,滴定终点的判断方法是
,此时溶液显 性。
(3)根据下表数据,计算被测烧碱溶液的物质的量浓度是 mol·L-1。]
滴定次数
| 待测溶液体积(mL)
| 标准酸体积
|
滴定前的刻度(mL)
| 滴定后的刻度(mL)
|
第一次
| 10.00
| 0.40
| 20.50
|
第二次
| 10.00
| 4.10
| 24.00
|
第三次
| 10.00
| 0.40
| 21.50
(4)分析下列实验操作会对滴定结果产生的影响。(填“偏高”、“偏低”或“无影响”)
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果 。
②若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果 。
③若烧碱溶液隔夜后滴定,选用甲基橙作指示剂时,则滴定结果 。
参考答案:(1) (B) (2) 当
本题解析:(1)因为石蕊试液的颜色变化不明显,不便于观察,所以不能选用石蕊试液作指示剂。
(2)甲基橙的变色范围是3.1~4.4,即溶液是显酸性的。所以盐酸滴定碱液终点的变化是当加入最后一滴标准的酸液时,溶液刚好由黄色变为橙色,且半分钟内不褪色。
(3)三次实验中消耗盐酸的体积分别为20.10ml、19.90ml、21.10ml,所以第三次的实验误差大,所以取前2次的平均值,即盐酸的体积是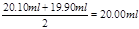 ,所以烧碱溶液的物质的量浓度是 ,所以烧碱溶液的物质的量浓度是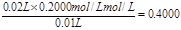 。 。
(4)开始俯视,则读数偏小,滴定终点平视,所以最终盐酸的体积偏大,结果偏高。锥形瓶用待测液润洗,则氢氧化钠的量偏多,消耗盐酸的体积偏大,结果偏高。烧碱溶液隔夜后滴定,则会含有杂质碳酸钠,但甲基橙的变色范围是在酸性环境中,所以根据原子守恒可知,消耗的盐酸是相同,不影响测定结果。
本题难度:一般
4、选择题 常温下,将0.1 mol·L-1盐酸溶液与0.06 mol·L-1氢氧化钡溶液等体积混合,该混合溶液的pH等于( )
A.1.7
B.2.0
C.12.0
D.12.4
参考答案:C
本题解析:
试题分析:根据题意可知:碱过量,所以酸碱混合后溶液显碱性,c(OH-)(后)=(0.06×2-0.1)÷2=0.01mol/L,根据水的离子积常数Kw=c(H+)· c(OH-)=1×10-14可得c(H+)=1×10-14÷0.01=10-12,所以pH=12,因此选项是C。
考点:考查酸碱混合溶液中溶液的pH计算的知识。
本题难度:一般
5、选择题 常温下某溶液,水电离出的c?(OH-)=1.0×10-4?mol/L,该溶液中溶质可能是( )
①Al2(SO4)3??②NaOH??③NH4Cl??④NaHSO4.
A.①②
B.①③
C.②③
D.①④
参考答案:B
本题解析:
本题难度:一般
|