微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知一种c(H+)=1×10-3mol/L的酸和一种c(OH-)=1×10-3mol/L的碱溶液等体积混合后溶液呈酸性其原因可能是( )
A.生成了一种强酸弱碱盐
B.等浓度的强酸和弱碱溶液反应
C.浓的强酸和稀的强碱溶液反应
D.浓的弱酸和稀的强碱溶液反应
参考答案:D
本题解析:生成了一种强酸弱碱盐,则碱是弱碱,所以碱过量,溶液应该显碱性,A不正确。同样B也是错误的,C中强酸和强碱恰好反应时,溶液显中性,不正确。D正确,酸是弱酸,酸过量,显酸性,所以正确的答案选D
本题难度:一般
2、选择题 有体积相同、pH相等的烧碱溶液和氨水,下列叙述中正确的是( )
A.两溶液物质的量浓度相同
B.用同浓度的盐酸中和时,消耗盐酸的体积相同
C.两溶液中OH-浓度相同
D.加入等体积的水稀释后,pH仍相等
参考答案:C
本题解析:氨水为弱电解质溶液,pH相同的NaOH与氨水,氨水的物质的量浓度大于NaOH溶液;NH3·H2O的物质的量大于NaOH,用同浓度的盐酸中和时氨水消耗盐酸要多;二者pH相同,[H+]相同,[OH-]也相同;加入等体积的水稀释后,由于氨水中存在电离平衡且平衡向右移动,使[OH-]比NaOH溶液中的[OH-]大,pH不相等。
本题难度:一般
3、选择题 常温下,0.1 mol/L某一元酸(HA)溶液中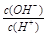 =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是
A.溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大
B.溶液中c(H+)+c(A-)=0.1 mol/L
C.溶液中水电离出的c(H+)=10-10 mol/L
D.与0.05mol/LNaOH溶液等体积混合后所得溶液中离子浓度大小关系为
c(A-)>c(Na+)>c(OH-)>c(H+)
参考答案:A
本题解析:常温下,水的离子积为1×10-14,结合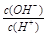 =1×10-8可得出,溶液中的
=1×10-8可得出,溶液中的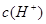 =1×10-3mol/L,可见一元酸没有完全
=1×10-3mol/L,可见一元酸没有完全
本题难度:一般
4、选择题 已知HCN、CN—在溶液中存在下列平衡及其对应的平衡常数:
①HCN H++CN— △H1>0 K1
H++CN— △H1>0 K1
②CN—+H2O HCN+OH- △H 2>0 K2
HCN+OH- △H 2>0 K2
常温下(K1=6.2×10-10),将等体积、等物质的量浓度的HCN和NaCN溶液混合,下列叙述正确的是
A.混合溶液的pH<7
B.对混合溶液进行微热,K1增大、K2减小
C.K2≈ 1.6×10-5
D.c(Na+) =" c(HCN)" + c(CN?)
参考答案:C
本题解析:
试题分析:A.由于不能确定HCN的电离程度与CN—的水解程度的相对大小,因此不能确定溶液的酸碱性,则混合溶液的pH不一定小于7,A错误;B.水解和电离都是吸热的,所以对混合溶液进行微热,K1、K2均增大,B错误;C.K2=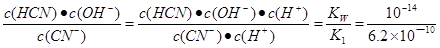 ≈1.6×10-5,C错误;D.根据物料守恒可知2c(Na+)=c(HCN) + c(CN?),D错误,答案选C。
≈1.6×10-5,C错误;D.根据物料守恒可知2c(Na+)=c(HCN) + c(CN?),D错误,答案选C。
考点:考查溶液酸碱性、水解常数、物料守恒以及外界条件对电离平衡和水解平衡的影响
本题难度:困难
5、选择题 下列关于弱电解质的说法正确的是:?????(???)
A.电解质越弱,则其溶液的导电能力就越差
B.同一弱电解质,浓度越大,电离程度越大
C.升高温度,弱电解质的电离程度减小
D.弱电解质的相对强弱可由相同温度下的电离常数值的大小来判断
参考答案:D
本题解析:A错误,电解质的强弱与其在溶液中导电能力的大小没有直接关系,溶液中导电能力大小只与溶液中的离子浓度和离子所带电荷数目有关。
B错误,对于弱电解质,浓度越大,电离程度越小。
C错误,电离过程是吸热,升高温度,弱电解质的电离平衡正向移动,电离程度增大。
D正确。
本题难度:简单