微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 已知反应A+3B==2C+D,在30s内A的浓度减小了0.5mol/L,则此段时间内以B的浓度变化表示的反应速率为____________mol/(L·min),以C的浓度变化表示的反应速率为___________mol/(L·min)。
参考答案:3;2
本题解析:
本题难度:一般
2、选择题 反应A(g)+3B(g) 2C(g)+2D(g),在不同条件下测得反应速率,其中速率最快的是[???? ]
2C(g)+2D(g),在不同条件下测得反应速率,其中速率最快的是[???? ]
A.??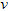 (D)=0.4?mol?/(L·s)
(D)=0.4?mol?/(L·s)
B.??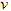 (C)=0.5?mol?/(L·s)
(C)=0.5?mol?/(L·s)
C.??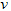 (B)=0.6?mol?/(L·s)
(B)=0.6?mol?/(L·s)
D.??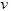 (A)=0.15?mol?/(L·s)
(A)=0.15?mol?/(L·s)
参考答案:B
本题解析:
本题难度:简单
3、计算题 已知反应:FeO(s)+CO(g)= Fe(s)+CO2(g)的Kc=0.5(1273K)。若起始浓度c(CO)=0.05 mol/L,c(CO2)=0.01 mol·L-1,请回答:
(1)计算CO 和CO2平衡浓度。
(2)CO的转化率是多少?
(3)增加FeO的量,对平衡有无影响?
参考答案:(1)反应将向右进行,CO和CO2的平衡浓度分别为0.04
本题解析:(1)考查可逆反应的有关计算,一般采用三段式,即
FeO(s)+CO(g)= Fe(s)+CO2(g)
起始浓度(mol/L)???????????? 0.05????????????????? 0.01
转化浓度(mol/L)????????????? x???????????????????? x
平衡浓度(mol/L)?????????? 0.05-x??????????????0.01+x
所以有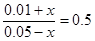
解得x=0.01mol/L
所以CO和CO2的平衡浓度分别为0.04 mol·L-1、0.02 mol·L-1。
(2)CO的转化率是0.01÷0.05×100%=20%
(3)氧化亚铁是固体,增加FeO的量,对平衡无影响。
本题难度:一般
4、填空题 (8分)常温下,关于下列两个反应:
a.0.1mol/L醋酸溶液:CH3COOH 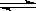 ?CH3COO-+H+
?CH3COO-+H+
b.0.1mol/L醋酸钠溶液:CH3COO-+H2O 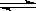 ?CH3COOH+OH-
?CH3COOH+OH-
(1)两式到达平衡后,在a中加入一定量的水后,平衡向________________移动,溶液的pH______(填“升高”“降低”“不变”)
(2)向b中加入同浓度的醋酸钠溶液,溶液的pH将_______(填“升高”“降低”“不变”),若加入少量的CH3COOH,使溶液中c(Na+)=c(CH 3COO-),则溶液的pH为_______
3COO-),则溶液的pH为_______ (填数值)。
(填数值)。
参考答案:(1)右(合理都对)、升高???? (2)不变、7
本题解析:略
本题难度:一般
5、选择题 已知:N2(g)+3H2(g)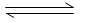 2 NH3(g)△H=-92kJ· mol-1若向体积为10L的恒温密闭容器中充入1.2 mol N2和0.6molH 2反应,由图像分析,下列叙述正确的是
2 NH3(g)△H=-92kJ· mol-1若向体积为10L的恒温密闭容器中充入1.2 mol N2和0.6molH 2反应,由图像分析,下列叙述正确的是
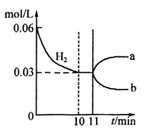
A.10~11min该反应的速率为v(H2)>0.003mol/(L·min)
B.若改变所用催化剂时,△H 会发生变化
C.若将上述密闭容器换作绝热密闭容器,其余条件不变,NH3的产率将降低
D.从11min起其它条件不变,压缩容器的体积,则c(H2 )的变化曲线为b
参考答案:C
本题解析:A错,10~11min,氢气的浓度没有变化,相当于反应速率为0
B错,改变所用催化剂,只能影响反应速率,但平衡不影响,即,△H 不会发生变化,
C正确,由于该反应的正反应为放热反应,随反应的进行,容器内温度升高,导致平衡会向逆反应方向移动,即NH3的产率将降低。
D错,从11min起其它条件不变,压缩容器的体积,则c(H2 )的浓度将突然增大,平衡将向正反应方向移动,即c(H2 )的浓度将又会慢慢下降,但不管怎样其浓度最终应比原来高。
本题难度:一般