微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 在900℃的空气中合成出一种含镧、钙和锰 (摩尔比2 : 2 : 1) 的复合氧化物,其中锰可能以 +2、+3、+4 或者混合价态存在。为确定该复合氧化物的化学式,进行如下分析:
⑴ 准确移取25.00 mL 0.05301 mol·L-1的草酸钠水溶液,放入锥形瓶中,加入25 mL蒸馏水和5 mL 6 mol·L-1的HNO3溶液,微热至60~70oC,用KMnO4溶液滴定,消耗27.75 mL。写出滴定过程发生的反应的方程式;计算KMnO4溶液的浓度。
⑵ 准确称取0.4460 g复合氧化物样品,放入锥形瓶中,加25.00 mL上述草酸钠溶液和30 mL 6 mol·L-1的HNO3溶液,在60~70oC下充分摇动,约半小时后得到无色透明溶液。用上述KMnO4溶液滴定,消耗10.02 mL。根据实验结果推算复合氧化物中锰的价态,给出该复合氧化物的化学式,写出样品溶解过程的反应方程式。已知La的原子量为138.9。
参考答案:⑴2MnO4- + 5C2O42- + 16H+ = 2Mn
本题解析:⑴此过程为标准溶液的标定,根据关系式5C2O42-~2MnO4-,用C2O42-标准溶液标定出MnO4-的浓度。
⑵该分析过程属于容量分析的返滴定类型,用KMnO4滴定过量的C2O42-。根据电子得失守恒关系,可列出下式
Mn元素得失电子数+5×n(MnO4-)=2×n(C2O42-)
求得Mn元素得失电子的物质的量为1.694 mmol
设复合氧化物的通式(La2Ca2MnO6+x),求得氧化物中Mn的物质的量,进而求得滴定过程中锰元素氧化数的变化,最终确定氧化物中
本题难度:一般
2、计算题 (6分)实验室用50mL浓盐酸跟足量的氯酸钾固体共热制取氯气,反应的化学方程式为(未配平)KClO3+HCl——HCl+Cl2↑+H2O
(1)配平上述反应化学方程式:
????????KClO3+ ????????HCl——???????KCl+ ????????Cl2↑+ ???????H2O
(2)若产生0.1mol Cl2,则转移电子的物质的量为????????mol。
(3)若反应中HCl的的利用率只有50%,当氧化产物比还原子能产物多7.1g时,求浓盐
酸的物质的量浓度。
参考答案:1)1? 6? 1? 3? 3?????(2)![]()
本题解析:略
本题难度:简单
3、填空题 (6分)请表示出下列方程式中电子转移的方向和数目,并回答下列问题
5KI+KIO3+3H2SO4=3I2+3K2SO4+3H2O
(1)此反应中,氧化剂是??????????,还原剂与氧化剂的物质的量之比是??????????
(2)当生成1.5mol I2时转移的电子数是??????????
参考答案: 本题解析:
本题解析:
试题分析: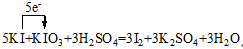
反应中元素化合价变化为:
I:-1→0???失1×5e-
I:+5→0???得5×1e-
氧化剂是KIO3、还原剂是KI,氧化剂与还原剂物质的量比为1:5。每生成3molI2转移电子数为5mol。
点评:氧化还原反应一定要分析清楚元素化合价变化。
本题难度:一般
4、选择题 在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,每摩尔CuSO4能氧化P的物质的量为
A.1/5 mol
B.2/5 mol
C.3/5mol
D.11/5 mol
参考答案:A
本题解析:略
本题难度:简单
5、选择题 已知氧化还原反应:KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
其中1 mol氧化剂在反应中得到的电子为(??? )
A.6 mol
B.5 mol
C.3 mol
D.4 mol
参考答案:B
本题解析:
试题分析:根据KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O可以知道KClO3为氧化剂,且KClO3中的Cl的化学价为+5,,反应后变为0价,所以1 mol氧化剂在反应中得到的电子为5mol,故本题的答案为B。
点评:本题考查了氧化还原反应,氧化还原反应是高考考查的重点和难点,本题部分学生很容易选择A选项,原因是不知道KClO3中的Cl的化学价转化为氯气中的氯。(氧化还原反应中元素的价态在邻价之间比较容易进行)
本题难度:一般