微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一定条件下,可发生反应:RO3n-+F2+2OH-==RO4-+2F-+H2O。则RO3n-中R元素的化合价是
A.+4
B.+5
C.+6
D.+7
参考答案:B
本题解析:略
本题难度:一般
2、选择题 将一定量的锌与100 mL 18.5 mol/L的浓硫酸充分反应后,锌完全溶解,同时生成气体A 33.6 L(标准状况)。将反应后的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol/L,则下列叙述中错误的是(??)
A.反应中消耗的Zn的质量为97.5 g
B.气体A中SO2和H2的体积比为1∶4
C.反应中被还原的元素只有一种
D.反应中共转移电子3 mol
参考答案:C
本题解析:解答本题应注意以下两点:(1)生成的33.6 L气体可能是SO2和H2的混合气体。
(2)假设反应的Zn一部分还原出SO2,一部分还原出H2,设未知数、列方程式计算。
本题难度:一般
3、填空题 已知氨气跟氯气可迅速反应生成氯化铵和氮气。当转移的电子总数为a个时,生成的氮气的物质的量bmol.

 ??(1)写出该反应配平的化学方程式:?????????????????????????????????????????
??(1)写出该反应配平的化学方程式:?????????????????????????????????????????
 ??(2)该反应中参加氧化还原反应的氧化剂和还原剂的物质的量之比为????????????。
??(2)该反应中参加氧化还原反应的氧化剂和还原剂的物质的量之比为????????????。
 ??(3)阿伏加德罗数常数为(用含a、b的代数式表示)?????????????????。
??(3)阿伏加德罗数常数为(用含a、b的代数式表示)?????????????????。
参考答案:(1)8NH3+3Cl2??6NH4Cl+N2
本题解析:根据电子转移守恒,配平的化学方程式8NH3+3Cl2??6NH4Cl+N2,根据化学方程式可知NH3为还原剂,Cl2为氧化剂,参加氧化还原反应的氧化剂和还原剂的物质的量之比为3:2.
本题难度:一般
4、选择题 0.02 mol FeS2与一定浓度的硝酸完全反应,Fe元素和S元素全部转化为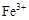 和
和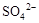 ,同
,同
时产生氮的氧化物(NO、NO2、N2O4)混合气体共0.25 mol,该混合气体的平均相对分子质量可能是
A.30
B.46
C.50
D.66
参考答案:BC
本题解析:
试题分析:根据电子守恒,0.02 mol FeS2,失电子总数:0.02*(1+14)=0.3mol,若产物全是NO,则为0.1mol,不可能。若产物全是NO2,物质的量为0.3mol这与混合气体共0.25 mol不符,不可能。若产物全是N2O4,物质的量为0.15mol这与混合气体共0.25 mol不符,不可能。所以产生气体的相对分子质量应该在(NO,NO2)和(NO2,N2O4)两种情况之间。若为(NO,NO2),设两者物质的量分别为:x,y,则有x+y="0.25,3x+y=0.3,x=0.
本题难度:一般
5、选择题 KClO3与浓盐酸发生如下反应:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,有关该反应,说法不正确的是:(??)
A.被氧化的元素和被还原的元素的质量之比5:1
B.Cl2既是氧化产物,又是还原产物
C.盐酸既体现酸性,又体现酸性还原性
D.转移5mol电子时,产生67.2L的Cl2
参考答案:D
本题解析:
试题分析:在反应KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O中,KClO3中的Cl得到电子,被还原变为Cl2,每摩尔的Cl得到5mol的电子,HCl中的Cl失去电子,也变为Cl2,每摩尔的Cl失去1mol的电子。A.由于在氧化还原反应中电子得失数目相等。因此被氧化的元素和被还原的元素的质量之比5:1。正确。B.Cl2既是氧化产物,又是还原产物。正确。C.在该反应中6mold HCl促进反应,有1mol的起酸的作用,有5mol的作还原剂。故在该反应中盐酸既体现酸性,又体现酸性还原性。正确
本题难度:一般