微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示。有关说法正确的是

A.a、b、c三点溶液的pH:a>b>c
B.若使C点的醋酸根离子浓度增大,溶液的pH也增大,可加入适量的醋酸钠固体
C.a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:a>b>c
D.用湿润的pH试纸测量c处溶液的pH值,比实际pH值偏小
参考答案:B
本题解析:略
本题难度:一般
2、选择题 已知相同温度下电离常数Ki(HF)>Ki(HCN)。在物质的量浓度均为0.1mol/L的NaCN和NaF混合溶液中,下列关系正确的是
A.c(F-)>c(OH-)>c(HCN)>c(HF)
B.c(F-)+c(HF)>c(CN-)+ c(HCN)
C.c(OH-)>c(F-)>c(CN-)>c(H+)
D.c(OH-)>c(HF)>c(HCN)>c(H+)
参考答案:A
本题解析:由于电离常数Ki(HF)>Ki(HCN),根据越弱越水解可知,c(HCN)>c(HF),排除D
再有:CN-+H2O HCN+OH-???? F-+H2O<=HF+OH-?? H2O
HCN+OH-???? F-+H2O<=HF+OH-?? H2O 本题难度:一般
本题难度:一般
3、填空题 (5分)常温下,将三种一元酸(HX、HY、HZ)分别和NaOH溶液等体积混合,实验数据如下:
酸
| c(一元酸) /mol·L–1
| c(NaOH) /mol·L–1
| 混合溶液的pH
|
HX
| 0.1
| 0.1
| pH = x
|
HY
| 0.1
| 0.1
| pH = 7
|
HZ
| 0.1
| 0.1
| pH = 9
(1)上述三种酸中一定属于强酸的是???,
(2)HZ和NaOH发生反应的离子方程式为???,所得溶液中pH大于7的原因是???(用化学方 程式表示)。
(3)HX反应后所得溶液中,由水电离产生的c(OH-)=???mol·L-1,下列叙述是对x 值的判断,其 中正确的是???。
A.一定=7?? B.可能<7??? C. 一定≧7??? D.一定>7
参考答案:(5分)(1)HY?????
(2)HZ +OH- =
本题解析:
试题分析:(1)等物质的量的酸与氢氧化钠混合,溶液的酸碱性取决于酸的强弱,若酸是强酸,则溶液呈中性,若酸是弱酸,则溶液呈碱性,所以上述三种酸中一定属于强酸的是HY;
(2)从HZ与氢氧化钠混合液的pH判断HZ是弱酸,酸性离子方程式时不能拆成离子形式,所以离子方程式为HZ +OH- ="=" H2O + Z-,所得溶液中pH大于7的原因是因为Z-水解使溶液呈碱性,水解的离子方程式为H2O + Z- 本题难度:一般 本题难度:一般
4、选择题 在0.1 mol/L的NH3·H2O溶液中,下列关系正确的是(???)
A.c(NH3·H2O)>c(OH-)>c(NH4+)>c(H+)
B.c(NH4+)>c(NH3·H2O)>c(OH-)>c(H+)
C.c(NH3·H2O)>c(NH4+)=c(OH-)>c(H+)
D.c(NH3·H2O)>c(NH4+)>c(H+)>c(OH-)
参考答案:A
本题解析:
【错解分析】电解质溶液中离子浓度大小比较问题,是高考的“热点”之一。多年以来全国高考化学试卷年年涉及这种题型。这种题型考查的知识点多,灵活性、综合性较强,有较好的区分度,它能有效地测试出学生对强弱电解质、电离平衡、水的电离、pH、离子反应、盐类水解等基本概念的掌握及对这些知识的综合运用能力。
【正解】NH3·H2O是一元弱酸,属于弱电解质,在水溶液中少部分发生电离(NH3·H2O 本题难度:一般 本题难度:一般
5、选择题 弱电解质的电离程度可用电离度(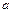 )表示: )表示: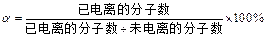 ,现有pH均为4的HCl和 ,现有pH均为4的HCl和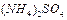 溶液,则两种溶液中H2O的电离度之比为( ) 溶液,则两种溶液中H2O的电离度之比为( )
A.1:2
B.2:5
C.1:106
D.106:1
参考答案:C
本题解析:略
本题难度:简单
|