微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是
A.0.1 mol/L溶液中的(NH4)2SO4溶液中的c(NH4+)<c(SO42-)
B.相同温度下,0.6 mol/L氨水溶液与0.3 mol/L氨水溶液中c(OH-)之比是2∶1
C.向0.1 mol/L NaNO3溶液中滴加硝酸使溶液pH=5,此时混合液中的c(Na+)<c(NO3-)
D.向醋酸钠溶液中加入适量醋酸,使混合液pH=7,此时混合液中c(Na+)<c(CH3COO-)
2、选择题 (10分)写出下列物质在水中的电离方程式:
NaHSO4 HClO
Al(OH)3 Ca(OH)2
H2CO3
3、填空题 (6分)下列10种物质中:①NaOH溶液②H2SO4③硫酸铜晶体④Cu ⑤CH3COOH?⑥NaOH固体⑦蔗糖⑧石灰水⑨水银⑩氨水
能导电的有???????????;属于强电解质的有????????;属于弱电解质的有????????。
4、选择题 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物质的量变化如图(其中I代表H2A,II代表HA-,III代表A2-,横坐标表示加入NaOH的体积)。根据图示判断,下列说法正确的是(???)
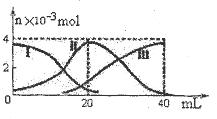
A.当V(NaOH)=20mL时,溶液中离子浓度大小关系:
C(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
B.HA-的电离程度小于水解程度
C.滴加过程中当溶液呈中性时,V(NaOH)<20mL
D.当V(NaOH)=40mL时,向所得溶液加水稀释的过程中pH增大
5、填空题 常温下,将0.01molCH3COONa和0.004molHCl溶于水,配制成0.5L混合溶液。判断:
(1)溶液中共有______________种微粒。
(2)溶液中有两种微粒的物质的量之和一定等于0.01mol,它们是______________和______________。
(3)溶液中n(CH3COO-)+n(OH-)-n(H+)=______________mol。