微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 若以w1、w2分别表示浓度为amol/L和bmol/L氨水的质量分数,且知2a=b,则下列推断正确的是[???? ]
A.w2>2w1
B.2w1=w2
C.2w2=w1
D.w1<w2<2w1
参考答案:A
本题解析:
本题难度:一般
2、选择题 人体血液的pH为7.35~7.45,其中含有一对物质能抵御外来的少量酸或碱而保持pH基本稳定,这对物质可能是(???)
A.NaCl-HCl
B.NaHCO3-H2CO3
C.NaOH-HCl
D.Na2CO3-HCl
参考答案:B??
本题解析:当在NaHCO3与H2CO3混合液中滴入少量酸,H+可与HCO3-结合成弱电解质H2CO3,使c(H+)基本不变;当加入少量碱,OH-又可与H2CO3生成HCO3-,使c(OH-)也基本不变。故NaHCO3-H2CO3混合溶液(缓冲溶液)具有题意的功能。
本题难度:一般
3、选择题 常温下,将稀NaOH溶液与稀CH3COOH溶液混合,不可能出现的结果是??? (??? )
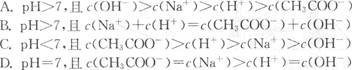
参考答案:A
本题解析:溶液中肯定c(Na+)>c(OH-)
本题难度:一般
4、选择题 化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂
HIn(溶液)  H+(溶液)+In-(溶液)
H+(溶液)+In-(溶液)
红色 黄色
浓度为0.02 mol·L-1的下列各溶液 ①盐酸 ②石灰水 ③NaCl溶液 ④NaHSO4溶液 ⑤NaHCO3溶液 ⑥氨水,其中能使指示剂显红色的是 ( )
A.②⑤⑥
B.①④
C.①④⑤
D.②③⑥
参考答案:B
本题解析:①盐酸,C(H+)增大,平衡逆向移动,显红色;②石灰水,消耗H+,则C(H+)减小,平衡正向移动,显黄色;③NaCl溶液,不影响平衡移动;④NaHSO4溶液中,会电离出H+,则C(H+)增大,平衡逆向移动,显红色;⑤NaHCO3溶液水解显碱性,消耗H+,则C(H+)减小,平衡正向移动,显黄色;⑥氨水同②石灰水,消耗H+,则C(H+)减小,平衡正向移动,显黄色
本题难度:一般
5、填空题 ⑵(12分) 18℃时,H2A(酸):K1=4.3×10-7,K2=2.1×10-12。H2B(酸):K1=1.0×10-7,K2=6.3×10-13,在浓度相同的两种溶液中,用“>”、“<”或“=”填空。
①H+的浓度:H2A________H2B;
②酸根离子的浓度:c (A2-)________c (B2-);
③酸分子的浓度:c (H2A)________c (H2B);
④溶液的导电能力:H2A________H2B。
参考答案:①> ②> ③<
本题解析:
试题分析:(1)相同温度、相同浓度的不同二元酸溶液中,c(H+)与电离平衡常数成正比,多元弱酸的电离以第一步为主,H2A的K1大于H2B,所以H2A电离程度大,溶液中c(H+)大;(2)相同温度、相同浓度下,电离平衡常数越大其电离程度越大,H2A的K2大于H2B,所以酸根离子的浓度c(A2-)> c(B2-);(3)相同温度、相同浓度下,电离平衡常数越大,其电离程度越大,H2A的K1大于H2B,所以H2A电离程度大,酸分子的浓度c(H2A)< c(H2B);(4)相同温度、相同浓度的不同二元酸溶液,c(H+)与电离平衡常数成正比,多元弱酸的电离以第一步为主,H2A的K1大于H2B,所以H2A的电离程度大,溶液中离子浓度H2A>H2B。
考点:弱电解质在水溶液中的电离平衡
点评:本题考查弱电解质的电离,明确电离平衡常数与电离程度的关系是解答本题的关键。
本题难度:一般