微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 以黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备二氧化氯气体,再用水吸收获得二氧化氯溶液。在此过程中需要控制适宜的温度, 若温度不当,副反应增加,影响生成ClO2气体的纯度,且会影响ClO2气体的吸收率。具体情况如图所示。请回答下列问题
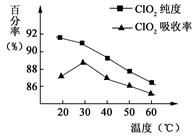
(1)据图可知,反应时需要控制的适宜温度是 ℃,达到此要求采取的适宜措施是 。
(2)已知:黄铁矿中的硫元素在酸性条件下被ClO3-氧化成SO42-,写出制备二氧化氯的离子方程式: 。
(3)某校化学学习小组拟以“m(ClO2)/m(NaClO3)”作为衡量ClO2产率的指标。若取NaClO3样品质量6.0g,通过反应和吸收可得400 mL ClO2溶液,取出20 mL,加入37.00 mL 0.500mol· (NH4)2Fe(SO4)2 溶液充分反应,过量Fe2+再用0.0500 mol·
(NH4)2Fe(SO4)2 溶液充分反应,过量Fe2+再用0.0500 mol· K2Cr2O7标准溶液滴定至终点,消耗20.00 mL。反应原理如下:
K2Cr2O7标准溶液滴定至终点,消耗20.00 mL。反应原理如下:
4H++ClO2+5Fe2+=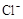 +5Fe3+ +2H2O 14H+ +
+5Fe3+ +2H2O 14H+ +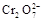 +6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O
+6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O
试计算来源:91考试网 91ExAm.orgClO2的“产率”。(写出计算过程)
参考答案:(1)30℃,水浴加热(或水浴控制恒温);(2)15ClO3
本题解析:
试题分析:(1)据图可知,在20℃反应时ClO2气体制取纯度高,但是气体的吸收率较低,在30℃无论是反应制取ClO2气体纯度高还是气体的吸收率都较高。若温度再升高,制取ClO2气体纯度高还是气体的吸收率都降低。所以需要控制的适宜温度是30℃。达到此要求采取的适宜措施是水浴加热(或水浴控制恒温)。(3)由方程式4H++ClO2+5Fe2+=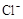 +5Fe3+ +2H2O 14H+ +
+5Fe3+ +2H2O 14H+ +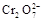 +6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O可结合电子得失守恒可得1×n(Fe2+)=5×n(ClO2)+2×3×n(Cr2O72-).与K2Cr2O7反应的n(Fe2+)=6n(Cr2O72-)=6×20×10-3L×0.0500mol/L=6×10-3mol;与ClO2反应的n(Fe2+)=37×10-3L× 0.0500mol/L -6×10-3mol=1.25×10-2mol。所以n(ClO2)=
+6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O可结合电子得失守恒可得1×n(Fe2+)=5×n(ClO2)+2×3×n(Cr2O72-).与K2Cr2O7反应的n(Fe2+)=6n(Cr2O72-)=6×20×10-3L×0.0500mol/L=6×10-3mol;与ClO2反应的n(Fe2+)=37×10-3L× 0.0500mol/L -6×10-3mol=1.25×10-2mol。所以n(ClO2)=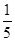 ×1.25×10-2mol=2.5×10-3mol。ClO2的“产率”=
×1.25×10-2mol=2.5×10-3mol。ClO2的“产率”=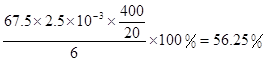 。
。
考点:考查反应条件的选择及采取的方法、氧化还原反应中的电子守恒、物质的产率的计算的知识。
本题难度:困难
2、填空题 (1)用盐酸可以除去铜器表面的铜绿,该反应的化学方程式为:
______?????????????????????????????????????????????______________
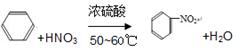
(2)写出苯发生硝化反应的化学方程式:
___________________________________________________________________
参考答案:(1)Cu2(OH)2CO3+4HCl=2CuCl2+3H2
本题解析:(1)Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑
(2)
本题难度:一般
3、选择题 下列化学用语正确的是(??)
A.表示乙炔“燃烧热”对应的热化学方程式:
C2H2(g)+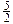 O2(g) = 2CO2(g)+H2O(g);?△H =-1 256 KJ/mol
O2(g) = 2CO2(g)+H2O(g);?△H =-1 256 KJ/mol
B.Na2O2的电子式:
C.卤化氢都极易溶于水,溶液均为强酸
D.表示中和热的热化学方程式:
NaOH(aq)+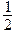 H2SO4(aq)=
H2SO4(aq)=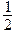 Na2SO4(aq)+H2O(l) ; △H = -57.3kJ/mol
Na2SO4(aq)+H2O(l) ; △H = -57.3kJ/mol
参考答案:D
本题解析:略
本题难度:一般
4、选择题 38.4g?Cu与适量的浓HNO3反应,Cu全部反应后,共收集到22.4L(标况)气体,反应消耗的HNO3物质的量可能是( )
A.1.0?mol
B.1.6?mol
C.2.2?mol
D.2.4?mol
参考答案:C
本题解析:
本题难度:一般
5、计算题 (6分)钙元素是人体必需的常量元素,所有的细胞都需要钙元素。正常人体血液含Ca2+为2.2×10-3 ~2.7×10-3mol·L-1。现抽取某人血样10ml。稀释后用草酸铵[(NH4)2C2O4]溶液处理,使Ca2+完全转变为草酸钙CaC2O4沉淀;过滤,洗涤,将得到的沉淀用稀硫酸溶解可得到草酸(H2C2O4),并用2.0ml 5.0×10-3 mol·L-1KMnO4溶液与溶解得到的草酸恰好完全反应。据此可以求此人血液中的Ca2+的浓度,并判断其血液含钙量是否正常。(提示2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2+8H2O)
(1)配制5.0×10-3 mol·L-1KMnO4 200mL溶液,需要称取KMnO4固体的质量是 g;
(2)每消耗草酸0.5mol,转移电子的物质的量为 mol;
(3)此人血液中的Ca2+的浓度为 mol·L-1。
参考答案:(各2分)(1)0.158 (2)1&
本题解析:
试题分析:(1)n(KMnO4)= 5.0×10-3 mol·L-1×0.2L=10-3 mol,KMnO4的质量为10-3 mol×158g/mol=0.158g。(2)反应2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2+8H2O转移的电子为10e-,所以每消耗草酸0.5mol,转移电子的物质的量为1mol 。(3)根据反应方程式和元素守恒可得到关系式:2KMnO4~5H2C2O~5CaC2O4,消耗了2.0ml 5.0×10-3 mol·L-1KMnO4溶液,则CaC2O4的物质的量为:25×10-6mol,血样取了10ml,所以Ca2+的浓度为:25×10-3 mol÷(10×10-3)=2.5×10-3mol·L-1
考点:物质的量的计算、氧化还原反应的电子转移、元素守恒规律的应用。
本题难度:一般