微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列溶液中导电性最强的是(???)
A.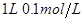 醋酸
醋酸
B.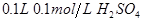 溶液
溶液
C. 盐酸
盐酸
D. 溶液
溶液
参考答案:B
本题解析:溶液的导电性强弱与溶液中阴阳离子的浓度大小和离子所带的电荷数有关系,溶液中氢离子最大的是硫酸中氢离子的浓度,所以选项B正确。
本题难度:简单
2、简答题 弱电解质的电离平衡、盐类的水解平衡和难溶物的沉淀溶解平衡均属于化学平衡.
I、已知H2A在水中存在以下平衡:H2A?H++HA-,HA-?H++A2-.
(1)Na2A溶液显碱性的原因______(用离子方程式回答).
(2)某温度下,若向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/LKOH溶液至溶液呈中性.此时该混合溶液中下列关系中,一定正确的是______.
A.c(H+)?c(OH-)=1×10-14B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)D.c(Na+)+c(K+)=0.05mol/L
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:
CaA(s)?Ca2+(aq)+A2-(aq)△H>0.
①降低温度时,Ksp______(填“增大”、“减小”或“不变”,下同).
②滴加少量浓盐酸,c(Ca2+)______.
II、(4)已知常温下Mg(OH)2在pH=12的NaOH溶液中Mg2+的浓度为1.8×10-7mol/L,则Ksp[Mg(OH)2]=______.
参考答案:(1)Na2A是强碱弱酸盐水解使溶液呈碱性,水解方程式为:A
本题解析:
本题难度:简单
3、选择题 下列叙述中正确的是( )
A.体积相同、浓度均为0.1mol/L的NaOH溶液、氨水,分别稀释m倍、n倍,溶液的pH都变成9,则m<n
B.有甲、乙两醋酸溶液,测得甲的pH=a,乙的pH=a+1,若用于中和等物质的量浓度等体积的NaOH溶液,需甲、乙两酸的体积V(乙)>10V(甲)
C.25℃,pH=9的NaOH溶液和NaAc溶液中,由水电离出的c(H+)均为10-5mol?L-1
D.c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)该式只能满足NaHCO3溶液中的离子浓度关系
参考答案:A、体积相同、浓度均为0.1mol/L的NaOH溶液、氨水都
本题解析:
本题难度:简单
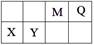
4、填空题 (9分)4种短周期元素相对位置如下表。M元素既是构成生物体的基本元素,又是构成 地壳中岩石和化石燃料的主要元素。回答下列问题:
(1)X的原子结构示意图为 。
(2)0.1 molQ的10电子氢化物与CuO反应生成Cu2O、H2O和Q单质时,生成Cu2O的物质的量是 。
(3)Y的氧化物与NaOH溶液反应的化学方程式是 。
(4)HR是含M元素的一元酸。常温下,0.1 mol·L-1 HR 溶液中,c(H+) =1.3×10-3 mol·L-1。则HR H++R-的电离平衡常数Ka= (保留一位小数)。
H++R-的电离平衡常数Ka= (保留一位小数)。
参考答案:(9分)
(1) 本题解析:
本题解析:
试题分析:M元素既是构成生物体的基本元素,又是构成地壳中岩石和化石燃料的主要元素,则M为C元素、Q为N元素、X为Mg元素、Y为Al元素。
(1)X为Mg元素,则X的原子结构示意图为: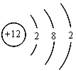
(2)Q的10电子氢化物为NH3,根据氧化还原反应中得失电子数相等可得对应关系:2NH3~3Cu2O,所以n(Cu2O)=3/2n(NH3)=3/2×0.1mol=0.15mol。
(3)Y的氧化物为Al2O3,属于两性氧化物,与NaOH溶液反应的化学方程式为:Al2O3+2NaOH+3H2O=2Na[Al(OH)4]。
(4)HR溶液中,H2O电离出的H+浓度非常小,可以忽略,所以HR电离平衡常数Ka=c(R-)?c(H+)/c(HR)= 1.3×10-3 ×1.3×10-3 /0.1=1.7×10-5。
考点:本题考查原子结构、元素周期律、氧化还原反应的计算、电离常数的计算。
本题难度:一般
5、选择题 化学中常借助图象来表示某种变化过程,下列关于4个图象的说法正确的是( )
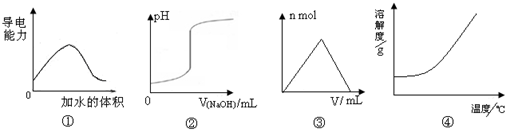
A.图①可表示t℃时,冰醋酸稀释过程中溶液导电性的变化
B.图②可表示向一定量盐酸中滴加一定浓度氢氧化钠溶液时,溶液pH的变化
C.图③可表示向一定量明矾溶液中滴加一定浓度氢氧化钡溶液时,产生沉淀的物质的量的变化
D.图④可表示所有的固体物质溶解度随温度的变化
参考答案:A.溶液导电性强弱取决于溶液中离子浓度的大小,纯净的醋酸不存
本题解析:
本题难度:一般