微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系.若25℃时有HA?H++A-,则该弱酸的电离平衡常数的表达式为K=______.下表是几种常见弱酸的电离平衡常数(25℃).
| 酸 | 电离方程式 | 电离平衡常数K
CH3COOH
CH3COOH?CH3COOH-+H+
1.76×10-5
H2CO3
H2CO3?H++HCO3-
HCO3-?H++HCO32-
K1=4.31×10-7
K2=5.61×10-11
H2S
H2S?H++HS-
HS-?H++S2-
K1=9.1×10-8
K2=1.1×10-12
H3PO4
H3PO4?H++H2PO4-
H2PO4-H++HPO42-
HPO42-?H++PO43-
K1=7.52×10-3
K2=6.23×10-8
K3=2.20×10-13
请回答下列各题:
(1)K只与温度有关,当温度升高时,K值______(填“增大”、“减小”或“不变”).
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?______.
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是______,最弱的是______.
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律是K1:K2:K3≈1:10-5:10-10,产生此规律的原因是:______.
参考答案:K=C(
本题解析:
本题难度:一般
2、选择题 用pH均为2的盐酸和醋酸溶液,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗盐酸和醋酸溶液的体积分别为Vl和V2,则Vl和V2的关系正确的是
[???? ]
A.V1>V2
B.V1<V2
C.V1=V2
D.V1≤ V2
参考答案:A
本题解析:
本题难度:一般
3、选择题 不能说明CH3COOH是弱酸的事实是
A.醋酸钠溶液显碱性
B.10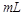 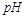 =2的醋酸溶液加水稀释到100 =2的醋酸溶液加水稀释到100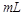 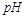  3 3
C.中和10 0.1 0.1 醋酸溶液,需要消耗0.1 醋酸溶液,需要消耗0.1 氢氧化钠溶液10 氢氧化钠溶液10
D.0.1 mol·L-1的醋酸溶液中,氢离子浓度约为0.001 mol·L-1
参考答案:C
本题解析:
试题分析:弱电解质的证明,是基于与强电解质对比进行的。弱电解质与强电解质最大的区别就是弱电解质存在电离平衡,而强电解质不存在电离平衡。因此只要证明有电离平衡存在,就证明了弱电解质。所以选项ABD均可以证明醋酸存在电离平衡。C中任何一元酸均消耗等量的氢氧化钠,不能证明,答案选C。
点评:该题是高考中的常见题型,试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,旨在培养学生的逻辑推理能力和抽象思维能力,提高学生的应试能力,调动学生的学习兴趣。该题的关
本题难度:一般
4、选择题 下列事实中,不能证明醋酸是弱酸的是
参考答案:
本题解析:
本题难度:一般
5、选择题 下列实验过程中产生的现象与对应图形相符合的是( )
A.
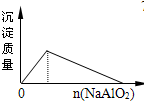
向盐酸中加入NaAlO2溶液
B.
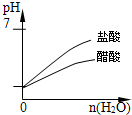
pH=1的醋酸和盐酸分别加等量水稀释
C.
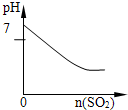
SO2气体通入溴水中
D.
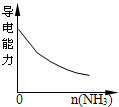
氨气通入醋酸溶液中
参考答案:A.在盐酸溶液中加入NaAlO2,发生反应分别为AlO2-+
本题解析:
本题难度:简单
|