微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列事实说明HNO2为弱电解质的是
①0.1 mol/L HNO2溶液的pH=2.1; ②常温下NaNO2溶液的pH>7 ; ③用HNO2溶液做导电实验时,灯泡很暗;④HNO2溶液和KCl溶液不发生反应 ⑤HNO2能与碳酸钠反应制CO2;⑥HNO2不稳定,易分解
A.①②③⑤
B.①②④⑤
C.①②⑥
D.①②
2、选择题 已知HA、H2B为二种弱酸,HA的电离常数为KHA,H2B的电离 常数为K1、K2,其大小依次是K1>KHA>K2,由此可以推测以下各反应中不
常数为K1、K2,其大小依次是K1>KHA>K2,由此可以推测以下各反应中不
能进行的是???????????????(???)
A.NaA+H2B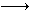 NaHB+HA???? B.2NaA+H2B
NaHB+HA???? B.2NaA+H2B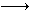 Na2B+2HA
Na2B+2HA
C.NaHB+HA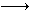 NaA+H2B???? D.Na2B+HA
NaA+H2B???? D.Na2B+HA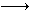 NaHB+NaA
NaHB+NaA
3、填空题 常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如表所示:
实验编号
| HA的物质的
量浓度(mol·L-1)
| NaOH的物质的
量浓度(mol·L-1)
| 混合后溶
液的pH
|
甲
| 0.1
| 0.1
| pH=a
|
乙
| 0.12
| 0.1
| pH=7
|
丙
| 0.2
| 0.1
| pH>7
|
丁
| 0.1
| 0.1
| pH=10
?
(1)从甲组情况分析,如何判断HA是强酸还是弱酸????????????????????????????????
(2)乙组混合溶液中离子浓度c(A-)和c(Na+)的大小关系是 ?? 。?
A.前者大????? B.后者大??? C.两者相等??? D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是 ?????????????。?
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)-c(A-)= mol·L-1。?
4、选择题 常温下,0.1 mol/L某一元酸(HA)溶液中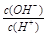 =1×10-8,下列叙述正确的是 =1×10-8,下列叙述正确的是
A.溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大
B.溶液中c(H+)+c(A-)=0.1 mol/L
C.溶液中水电离出的c(H+)=10-10 mol/L
D.与0.05mol/LNaOH溶液等体积混合后所得溶液中离子浓度大小关系为
c(A-)>c(Na+)>c(OH-)>c(H+)
5、选择题 现有室温下的四种溶液,其pH如下表所示,下列有关叙述不正确的是
| ①
| ②
| ③
| ④
| pH
| 11
| 11
| 3
| 3
| 溶液
| 氨水
| NaOH溶液
| 醋酸
| 盐酸
A.③④中分别加入适量醋酸钠晶体,两溶液pH均增大
B.②③两溶液等体积混合,所得溶液中:c(H+)>c(OH-)
C.分别加水稀释10倍,溶液的pH:①>②>④>③
D.V1L④和V2L①溶液混合后,若pH=7,则V1<V2
|
|