微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知 K2HPO4溶液中水解
K2HPO4溶液中水解 程度大于电离程度,对于平衡HPO42-+H2O
程度大于电离程度,对于平衡HPO42-+H2O 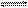 ?H
?H 3O++PO43-,欲使溶液中c(HPO42-)、c(PO43-)、c(H3O+)三种离子浓度均减少,可采用的方法是(???)
3O++PO43-,欲使溶液中c(HPO42-)、c(PO43-)、c(H3O+)三种离子浓度均减少,可采用的方法是(???)
A.加水
B.加热
C.加消石灰
D.加AgNO3
参考答案:C
本题解析:略
本题难度:一般
2、选择题 常温下,0.1 mol·L-1CH3COONa溶液pH =a,则下列说法正确的是
A.CH3COOH在常温下Ka数值约为l×101-2a
B.约有1.0×l0a-14 mol·L-1的水发生电离
C.加热后溶液pH <a
D.加少量水后,溶液pH >a
参考答案:B
本题解析:
试题分析:由水的离子积常数与水解平衡常数可计算出电离平衡常数,可判断A错;由于水解是一个吸热反应过程,故加热后水解平衡正向移动,氢氧根离子浓度增大,碱性增强,pH增大;加水稀释后溶液的浓度减小,故碱性减弱,pH减小。
考点:考查水解平衡的相关知识点
本题难度:一般
3、选择题 用水稀释0.5mol·L-1的醋酸(CH3COOH)溶液,其中随水量的增加而增大的是[???? ]
①H+的物质的量 ②c(H+) ③c(H+)/c(CH3COOH) ④c(CH3COOH)/c(CH3COO-) ⑤c(OH-)
A、①③⑤
B、①④⑤
C、②④
D、③④
参考答案:A
本题解析:
本题难度:一般
4、选择题 重水(D2O)的离子积C(D+)?C(OD-)=1.6×10-15,可以用pH一样的定义来规定pD=-lg?c(D+).下列关于pD的叙述正确的是( )
A.中性溶液pD=7
B.含0.01mol/LNaOD的D2O溶液1L?pD=12
C.溶解0.01mol?DCl的D2O溶液1L?pD=2
D.在100ml0.25mol/L的DCl重水溶液中,加入50ml0.2mol/L的NaOD重水溶液,pD=1.0
参考答案:A、若pD=7,则中性溶液中,c(D+)=c(OD-)=10
本题解析:
本题难度:简单
5、简答题 水溶液中存在水的电离平衡.
(1)常温时,在稀溶液中c(H+)和c(OH-)的乘积总是等于______.
(2)用“>”、“<”或“=”填空:碱性溶液中,c(H+)______c(OH-),在常温时pH______7.
(3)有下列几种溶液:a.NH3?H2Ob.CH3COONac.NH4Cld.NaHSO4
常温下呈酸性的溶液有______(填序号)用离子方程式或电离方程式表示这些溶液呈酸性的原因:______.
参考答案:(1)常温下Kw=c(H+)×c(OH-)=10-14,故答
本题解析:
本题难度:简单