微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3=2Al+3CO2↑+9H2O。根据题意完成下列填空:
(1)冰晶石的化学式为???????,含有离子键、???????等化学键。
(2)生成物中含有10个电子的分子是???????(写分子式),该分子的空间构型为???????,中心原子的杂化方式为???????。
(3)反应物中电负性最大的元素为???????(填元素符号),写出其原子最外层的电子排布图:???????。
(4)Al单质的晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。
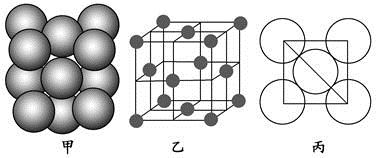
若已知Al的原子半径为d,NA代表阿伏加德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为???????;Al晶体的密度为???????(用字母表示)。
参考答案:(1)Na3AlF6 配位键
(2)H2O V形 sp
本题解析:(1)冰晶石的化学式为Na3AlF6,Na+与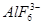 之间为离子键,而
之间为离子键,而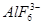 是以配位键形成的。(2)生成物中10电子分子是H2O
是以配位键形成的。(2)生成物中10电子分子是H2O
本题难度:一般
2、选择题 100 mL浓度为2 mol·L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是
A.加入适量6 mol·L-1的盐酸
B.加入少量醋酸钠固体
C.加热
D.加入少量金属钠
参考答案:C
本题解析:试题分析:本题中关于影响反应速率的因素有浓度、压强、温度等,此题与压强、催化剂无关。从浓度与温度因素考虑,已知酸不足,A加入6 mol·L-1的盐酸后,c(H+)增大,反应速率增大的同时生成氢气的总量也增大,不符合题意;B加入醋酸钠固体,强酸制弱酸生成了少量醋酸,降低了反应速率;D加入少量钠后,钠可以与水反应使生成氢气量增大,只有C符合,即答案选C。
考点:考查外界条件对反应速率的影响
点评:该题是高考中的常见题型,属于中等难度的试题。试题贴近高考,注重基础和能力的双向。该题需要注意的是改变反应速率与改变生成物的量是不同的概念,要注意一因多效和多因一效的区别。
本题难度:简单
3、选择题 关于化学键的下列表述中,正确的是( )
A.共价化合物可能含有离子键
B.离子化合物中可能含有共价键
C.离子化合物中只含有离子键
D.硫酸中含有离子键
参考答案:A.共价化合物只含共价键,组成微粒为分子,不存在离子之间的静
本题解析:
本题难度:一般
4、选择题 C、CO、CH4、C2H5OH是常用的燃料,他们每1mol分别完全燃烧生成CO2(g)及H2O(l)时,放出的热量依次为393.5kJ、283.0 kJ、890.3 kJ、1366.8 kJ。相同质量的这4种燃料,完全燃烧时放出热量最多的是:( )
A.C B. CO C. CH4 D. C2H5OH
参考答案:C
本题解析:
试题分析:设4种燃料的质量为m,则n(C)=" m/12" mol,n(CO)=" m/28" mol ,n(CH4)=" m/16" mol ,n(C2H5OH)=" m/46" mol,完全燃烧时放出热量:C为m/12×393.5kJ="32.8m" kJ,CO为m/28×283.0 kJ="10.1m" kJ
CH4为m/16×890.3 kJ="55.6m" kJ,C2H5OH为m/46×1366.8 kJ="29.7m" kJ,故C正确。
考点:反应热的简单计算。
本题难度:一般
5、填空题 拆开1 mol H—H键,1 mol N—H键,1 mol N≡N键分别需要吸收的能量为436 kJ,391 kJ,946 kJ。则1 mol N2生成NH3_1____热量(填“吸收”或“放出”) _2__ kJ;理论上,每生成1 mol NH3__3_热量(填“吸收”或“放出”) 4 kJ;事实上,反应的热量总小于理论值,为什么?_________5_________________。
参考答案:
1 放出
本题解析:
试题分析:(1)在反应N2+3H2 2NH3中,
2NH3中,
断裂3mol H-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2346kJ-2254kJ=92kJ;每生成1 mol NH3同样也是放热,热量为原来的一半,46kJ。由于反应为可逆反应,所以不能完全反应,反应的热量总小于理论值。
考点:键能的计算,反应热的计算
点评:本题涉及到了键能的计算和反应热的计算,计算难度不大,从键能上分析,断键放出的热量减去成键吸收的热量就是反应总的放出的热量。
本题难度:一般