微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3=2Al+3CO2↑+9H2O。根据题意完成下列填空:
(1)冰晶石的化学式为???????,含有离子键、???????等化学键。
(2)生成物中含有10个电子的分子是???????(写分子式),该分子的空间构型为???????,中心原子的杂化方式为???????。
(3)反应物中电负性最大的元素为???????(填元素符号),写出其原子最外层的电子排布图:???????。
(4)Al单质的晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。
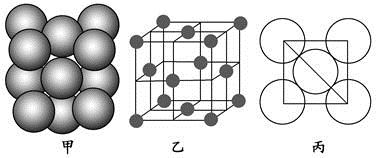
若已知Al的原子半径为d,NA代表阿伏加德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为???????;Al晶体的密度为???????(用字母表示)。
2、选择题 100 mL浓度为2 mol·L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是
A.加入适量6 mol·L-1的盐酸
B.加入少量醋酸钠固体
C.加热
D.加入少量金属钠
3、选择题 关于化学键的下列表述中,正确的是( )
A.共价化合物可能含有离子键
B.离子化合物中可能含有共价键
C.离子化合物中只含有离子键
D.硫酸中含有离子键
4、选择题 C、CO、CH4、C2H5OH是常用的燃料,他们每1mol分别完全燃烧生成CO2(g)及H2O(l)时,放出的热量依次为393.5kJ、283.0 kJ、890.3 kJ、1366.8 kJ。相同质量的这4种燃料,完全燃烧时放出热量最多的是:( )
A.C B. CO C. CH4 D. C2H5OH
5、填空题 拆开1 mol H—H键,1 mol N—H键,1 mol N≡N键分别需要吸收的能量为436 kJ,391 kJ,946 kJ。则1 mol N2生成NH3_1____热量(填“吸收”或“放出”) _2__ kJ;理论上,每生成1 mol NH3__3_热量(填“吸收”或“放出”) 4 kJ;事实上,反应的热量总小于理论值,为什么?_________5_________________。