微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 25℃时,水的电离达到平衡: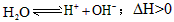 。下列叙述正确的是[???? ]
。下列叙述正确的是[???? ]
A.向水中加入稀氨水,平衡逆向移动, 降低
降低
B.向水中加入少量固体硫酸氢钠,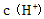 增大,Kw不变
增大,Kw不变
C.向水中加入少量 固体,平衡逆向移动,
固体,平衡逆向移动,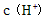 降低
降低
D.将水加热,Kw增大,pH不变
2、填空题 (1)pH=13的CH3COONa溶液加水稀释100倍后,pH 11(填“>”“=”或“<”),原因是 (用离子方程式和必要的文字说明);pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH NaOH溶液的pH(填“>”“=”或“<”);
(2)pH相等时,①NH4Cl ②(NH4)2SO4 ③NH4HSO4三种溶液中c(NH4+)由大到小的顺序为 ;
(3)等体积、等浓度的氢氧化钠与醋酸混合后溶液呈 性,溶液中c(Na+) c(CH3COO-)(填“>”“=”或“<”);pH=13的氢氧化钠与pH=1的醋酸等体积混合后溶液呈 性,溶液中c(Na+)
c(CH3COO-)(填“>”“=”或“<”);
(4)25℃,用0.1000 mol / LNaOH溶液滴定20.00mL0.1 000mol/L某一元酸HA溶液所得滴定曲线如图。
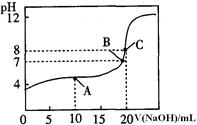
①为减小实验误差,由图可知滴定时指示剂应选用 (填“石蕊”、“酚酞”、“甲基橙”);
②A、B、C三点所示溶液导电能力最强的是 点对应的溶液;
③25OC,HA的电离平衡常数约为 。
3、填空题 (12分)(1)25℃时,pH=12.0的KOH溶液中,由水电离出的c(OH-)=_______mol/L;pH=12.0的K2CO3溶液中,由水电离出来的c(OH-)=_______mol/L。
(2)常温下0.1mol·L-1 CH3COONa溶液PH=8
①用离子方程式表示CH3COONa溶液PH=8的原因: 。
②按物质的量浓度由大到小顺序排列该溶液中各种微粒(水分子除外) 。
(3)FeCl3的水溶液呈 (填“酸”、“中”、“碱”)性,原因是(用离子方程式表示): 。
4、选择题 下列说法中,正确的是( ? )
A.在任何条件下,纯水的pH=7
B.在任何条件下,纯水都呈中性
C.在95℃时,纯水的pH>7
D.在95℃时,纯水中H+的物质的量浓度c(H+)<10-7mol/L
5、填空题 (9分)在常温下,下列五种溶液:
①0.1mol/L NH4Cl ②0.1mol/L CH3COONH4 ③0.1mol/L NH4HSO4
④0.1mol/L NH3·H2O和0.1mol/L NH4Cl混合液 ⑤0.1mol/L NH3·H2O
请根据要求填写下列空白:
(1)溶液①呈 性(填“酸”、“碱”或“中”),其原因是 用离子方程式表示)
(2)在上述五种溶液中,pH最小的是 ;c(NH4+)最小的是