|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列装置不能完成的实验是( )
?
| A
| B
| C
| D
| 装
置
| 
| 
| 
| 
| 实
验
| 结合秒表粗略测量锌与硫酸的反应速率
| 制备并收集少量NO气体
| 验证温度对化学平衡的影响
| 铁的析氢腐蚀实验
?
参考答案:D
本题解析:A选项生成气体体积可以通过注射器刻度表示,结合秒表所用时间,就可测定出反应速率,A正确;浓硝酸与铜反应生成的是NO2,NO2与水反应生成NO,最终收集到的是NO,B正确;由于NO2是红棕色,N2O4是无色气体,可以通过气体的颜色变化来表示平衡的移动方向,C正确;D选项中食盐水为中性条件,主要发生吸氧腐蚀,不能达到实验目的。
本题难度:一般
2、实验题 (8分)用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶液于一洁净的锥形瓶中,然后用0.2000mol·L -1的氢氧化钠溶液(指示剂为酚酞)滴定得结果如下:
?
| NaOH起始读数
| NaOH终点读数
| 第一次
| 0.40mL
| 18.50mL
| 第二次
| 1.30mL
| 18.05mL
| 第三次
| 3.10mL
| 21.20mL
?(1)达到滴定终点的时溶液颜色的变化为?? ????色到??????色; ????色到??????色;
(2)根据以上数据可以计算出盐酸的物质的量浓度为????????????;
(3)以下操作造成测定结果偏高的原因可能是????????????。
A.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.未用标准液润洗碱式滴定管
参考答案:(1)??无????(浅)红????(2)? 0.1448
本题解析:略
本题难度:一般
3、实验题 某研究性学习小组研究外界因素对反应速率的影响。下表是稀硫酸与某金属反应的实验数据

分析上述数据,回答下列问题:
(1)实验1和2表明,____________对反应速率有影响,____________反应速率越快。
(2)实验1和4的研究的是____________对反应速率的影响。
(3)实验1和3研究的是____________对反应速率的影响,实验表明____________,反应速率加快。
(4)本实验中影响反应速率的其他因素还有____________,其实验序号是____________。
(5)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因:________________________。
参考答案:(1)固体的表面积;固体表面积越大
(2)反应物浓度<
本题解析:
本题难度:一般
4、实验题 某课外活动小组加热炭粉(过量)和氧化铜的混合物,再用下图装置,对获得的铜粉(含炭)样品进行实验。图中铁架台等装置已略去。请你帮助他们完成下列实验报告。
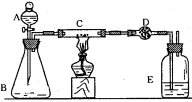
(1)实验目的:测定铜粉样品中铜的质量分数
(2)实验用品:仪器:天平、分液漏斗、锥形瓶、硬质玻璃管、干燥管、酒精灯、洗气瓶等,药品:红褐色铜粉(含炭)样品、过氧化氢溶液、二氧化锰、碱石灰、浓硫酸等。
(3)实验内容(见表1)表1?实验步骤、现象及化学方程式:
(4)计算:样品中铜的质量分数=______。(用含W、m1、m2的代数式表示。)
(5)问题和讨论:实验完成后,老师评议说:按上述实验设计,即使C中反应完全、D中吸收完全,也不会得出正确的结果。经讨论,有学生提出在B与C之间加入一个装置,再次实验后,得到了较正确的结果。那么,原来实验所测得的铜的质量分数偏小的原因可能是__________。在B与C之间加入的 装置可以是_____________,其中盛放的药品是____________。 装置可以是_____________,其中盛放的药品是____________。
参考答案:(3)
B、E中有气泡产生
 本题解析:略 本题解析:略
本题难度:简单
5、实验题 (14分)某同学用图示装置进行铁和稀硝酸反应的实验并进行相关的实验探究。

a.向广口瓶内注入足量热NaOH溶液,将盛有一定质量的纯铁粉的小烧杯放入瓶中。
b.关闭止水夹,点燃红磷,伸人瓶中,塞好胶塞。
c.待红磷充分燃烧,一段时间后打开分液漏斗旋塞,向烧杯中缓慢滴入一定量的4mol·L-1的稀硝酸,
铁粉完全溶解。
(一)气体产物成分探究
(1)实验前如何检查该装置的气密性????????????????????????????????????。
(2)燃烧红磷的目的是??????????????。
(3)为证明气体产物为NO,步骤c后还缺少的一步主要操作是???????????。
(二)产物中铁元素价态探究:
(1)提出合理假设:
假设1:产物中只有+2价铁;假设2:?????????????,假设3:产物中既有+2价铁,又有+3价铁。
(2)设计实验方案,验证假设1成立(写出实验操作步骤、现象和结论):????????????????????。
(三)问题讨论
(1)广口瓶中热NaOH溶液的主要作用是??????????????。
(2)若假设3成立,且所得溶液中n(Fe2+):n(Fe3+)=3:1时,则对应的离子反应方程式为??????。
参考答案:(一)(1)关闭止水夹,通过分液漏斗向广口瓶中加水,当水不能
本题解析:
试题分析:(一)(1)实验前检查该装置的气密性的方法是关闭止水夹,通过分液漏斗向广口瓶中加水,当水不能顺利滴下时停止加水。观察分液漏斗中水面,若水面不下降,说明装置气密性良好;(2)燃烧红磷的目的是除去广口瓶内空气中的氧气,避免干扰铁和稀硝酸反应产生的气体检验;(3)为证明气体产物为NO,步骤c后还缺少的一步主要操作是打开止水夹,向瓶内迁入少量空气(或氧气),看气体是否变为红棕色,若变为红棕色,就证明产生了NO,否则没有。(二)(1)假设1:产物中只有+2价铁;假设2:产物中只有+3价铁;假设3:产物中既有+2价铁,又有+3价铁。(2)证明只有+2价铁的实验方案是取小烧杯中反应后溶液少许,放入一只试管中,滴加KSCN溶液。溶液不显红色,再向其中滴加少量的H2O2溶液,溶液显红色。则证明假设1成立。?(三)问题讨论(1)广口瓶中热NaOH溶液的主要作用是将实验结束后,在充入足量空气(或氧气)的条件下,将瓶中氮的氧化物完全吸收,以防止空气污染;(2)若产物中既有+2价铁,又有+3价铁,且所得溶液中n(Fe2+):n(Fe3+)=3:1时,根据电子守恒可得相应的离子反应方程式为4Fe+12H++3NO3-=3Fe2++Fe3++3NO↑+5H2O。
本题难度:一般
|
|
|