微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:
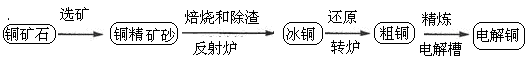
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转化为低价氧化物。该过程中两个主要反应的化学方程式是?????????、??????????,反射炉内生成炉渣的主要成分是??????????;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式是??????????、???????????;
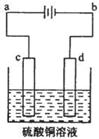
(3)粗铜的电解精炼如图所示。在粗铜的电解过程中,粗铜板是图中电极??????????(填图中的字母);在电极d上发生的电极反应式为??????????;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为?????????????。
参考答案:(1) 2CuFeS2 + O2 本题解析:
本题解析:
试题分析:(1) Cu和Fe的低价硫化物为Cu2S 和 2FeS,因此有: 2CuFeS2 + O2 ?Cu2S + 2FeS + SO2
?Cu2S + 2FeS + SO2
2FeS + 3O2
本题难度:一般
2、填空题 (16分)金属单质及其化合物与工农业生产、日常生活有密切的联系。请回答下列问题:

(2)一定温度下,氧化铁可以与一氧化碳发生如下反应:
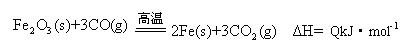
①该温度时,在2 L盛有Fe2O3粉末的密闭容器中通入CO气体,5 min后,生成了单质铁11.2 g,则这段时间内CO的反应速率为?????????????;
②达平衡后,若温度升高,的值增大,则Q????0(填“>”、“=”、“<”)。
(3)工业常根据金属氢氧化物在酸中溶解度不同,通过控制溶液的pH,达到分离金属离子的目的。如是难溶金属的氢氧化物在不同pH下的溶解情况(s/mol·L-1)。若要除去CuCl2溶液的少量Fe3+,应控制溶液的pH为????????(填序号)。???

A.小于l??? B.4左右?????? C.大于6??? D.大于9
(4)某工业废水中含有Cu2+、Pb2+、Hg2+,若向工业废水中加入过量的FeS,当FeS、CuS、PbS和HgS共存时,溶液中c(Fe2+):c(Pb2+):c(Hg2+)=??????????:?????????:?????????。
已知:Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(PbS)=3.4×10-28mol2·L-2
Ksp(CuS)=1.3×10-36mol2·L-2,Ksp(HgS)=6.4×10-53mol2·L-2
(5)依据氧化还原反应:Cu2+(aq)+Fe(s)===Fe2+(aq)+Cu(s)设计成如图所示的原电池,则关于该电池装置的说法中不正确的是???????(填序号)。
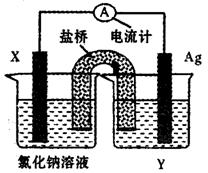
A.电极X的材料是Fe
B.电解质溶液Y是AgNO3溶液
C.原电池工作时,盐桥中的阴离子不断移向左池的氯化钠溶液中
D.原电池工作时,x电极反应为:O2+2H2O+4e-→4OH-
参考答案:(1)-824.4KJ/mol
(2)?①0.03mo
本题解析:略
本题难度:简单
3、实验题 (16分)某研究性学习小组在用CO还原Fe2O3的实验中,用磁铁吸出生成的黑色粉末X,他们认为X不一定是Fe,因温度不同、受热不均时会生成Fe3O4且也能被磁铁吸引。为探究X的组成,他们进行了如下实验。
Ⅰ.定性检验
实验编号
| 实验操作
| 实验现象
|
①
| 取少量黑色粉末X放入试管1中,注入适量稀盐酸,微热。
| 黑色粉末逐渐溶解,有无色气体逸出。
|
②
| 向试管1所得溶液中滴加几滴
KSCN溶液,振荡。
| 溶液未出现血红色
(1)由上述实验现象推断,黑色粉末X的成分中是否一定不含Fe3O4?____(填“是”或“否”)。
(2)实验①中可能发生反应的离子方程是????????,???????????,????????????。
Ⅱ.定量测定
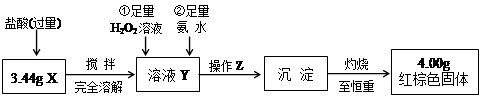
(3)操作Z是????????????????。在灼烧沉淀时必须用到的下列仪器的名称是____________________________。

(4)通过以上数据,得出3.44g黑色粉末X中各成分的物质的量为:______、______。
参考答案:(1)否(2分)?(2)Fe3O4 + 8H+ ="=="
本题解析:(1)由于在单质铁的存在下,铁离子是不可能存在的,所以不能确定是否含有四氧化三铁。
(2)有无色气体逸出,说明含有单质铁,反应的方程式是Fe + 2H+ ="=" Fe2+?+ H2↑;又因为还可能存在四氧化三铁,所以还可能发生的反应是Fe3O4 + 8H+ ==Fe2+?+ 2Fe3+ + 4H2O、2Fe3+ + Fe ="==" 3Fe2+。
(3)沉淀从溶液中分离出的方法是过滤,且在过滤之后还必需洗涤;固体的灼烧需要坩埚,而坩埚需要放在三脚架的泥三角上。
(4)设混合物中四氧化三
本题难度:一般
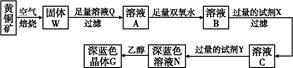
4、填空题 工业上以黄铜矿(主要成分是CuFeS2,杂质不溶于水和酸)为原料,制备蓝色晶体G,其化学式为[Cu(NH3)4]SO4·H2O,涉及流程如下:
已知25 ℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表:
?
| Fe(OH)2
| Cu(OH)2
| Fe(OH)3
| Ksp
| 8.0×10-16
| 2.2×10-20
| 4.0×10-38
| 完全沉淀pH
| ≥9.6
| ≥6.4
| ≥3.2
?
(1)加快黄铜矿焙烧速率,可采用的措施有????????????????????????????????????????????(写两种)。
(2)加入双氧水可能发生反应的离子方程式为???????????????????????????????????????????????????;
试剂X的化学式为 。
(3)常温下,0.1 mol/L试剂Y的pH=11,则该温度下,试剂Y的电离常数为 ,用pH试纸测该溶液pH的方法是???????????????????????? 。
(4)已知Cu(OH)2+4NH3·H2O [Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式: 。 [Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式: 。
(5)在溶液N中加入乙醇的目的是?????????????????????????????????????????????????? 。
参考答案:(1)将黄铜矿粉碎、升高温度、增大空气流速(任选两种)
本题解析:(1)对于固体反应物燃烧来讲,加快化学反应速率的措施有:①增大固体接触面积;②升高温度;③增大空气流速(即增大O2浓度);④利用超声波等;结合本题的情况,①②③都符合。
(2)从该题的工艺流程,再结合产物的阴离子,溶液Q应为H2SO4溶液,则溶液A中有:Fe2+、Fe3+、Cu2+和过量H2SO4,再结合所给数据,知此工艺应将Fe2+ 本题难度:一般 本题难度:一般
5、选择题 在Fe2(SO4)3溶液中,加入a g铜,完全溶解后,再加b g铁,充分反应后得到c g残余固体,且a>c,则下列说法正确的是(?? )
A.残余固体是铜和铁
B.最后得到的溶液中一定含有Cu2+
C.将残余固体加入到稀硫酸中,有气泡产生
D.最后得到的溶液中可能含有Fe3+
参考答案:B
本题解析:
试题分析:加入的a克铜粉由于发生了如下的反应2Fe3++Cu=2Fe2++Cu2+而全部溶解,如果这部分铜在加入b克铁粉后被全部还原出来,则c应与a相等;现题给条件中已知a>c,这明加入的a克铜没有全部被还原,溶液中还有Cu2+,同时也说明加入的铁粉不足(否则a克铜将会被全部还原出来),加入的铁被氧化成Fe2+;而Fe3+由于不能与单质铜共存,说明在溶液中已经不再存在;综上所述,说明
本题难度:一般
|
|