微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:
NH3+CO2+H2 O
O ???NH4HCO3;? NH4HCO3+NaCl ???NaHCO3↓+NH4Cl ;
2NaHCO3 Na2CO3
Na2CO3 +CO2↑+H2O
+CO2↑+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是??????(填字母标号);
a.碳酸氢钠难溶于水????????????
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小, 所以在溶液中首先结晶析出
所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制 碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
① 一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如右图所示(图中夹持、固定用的仪器未画出)。
试回答下列有关问题:
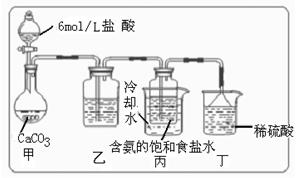
 (Ⅰ)乙装置中的试剂是??????
(Ⅰ)乙装置中的试剂是?????? ????
????
(Ⅱ)丁装置中稀硫酸的作用是????????????
(Ⅲ)实验结束后,分离出NaHCO3晶体的操作是?????????(填分离操作的名称)。
(IV)请你再写出一种实验室制取少量碳酸氢钠的方法:??????????????????。
参考答案:(1)C??????????????
(2)(Ⅰ)饱和
本题解析:略
本题难度:简单
2、选择题 下列工业生产中,各物质的物质的量间的关系式不正确的是(??)
A.制漂白粉:2Cl2~Ca(ClO)2
B.制H2SO4:FeS2~2H2SO4
C.合成氨:C~H2~2/3NH3
D.制HNO3:NH3~HNO3
参考答案:C
本题解析:A中的化学反应方程式是2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O;B中的反应是4FeS2+11O2=2Fe2O3+8SO2,2SO2+O2 2SO3,SO3+H2O=H2SO4,根据S原子守恒可得B是正确的;C中的反应是C+H2O=CO+H2,CO+H2O=CO2+H2,N2+3H2
2SO3,SO3+H2O=H2SO4,根据S原子守恒可得B是正确的;C中的反应是C+H2O=CO+H2,CO+H2O=CO2+H2,N2+3H2
本题难度:一般
3、选择题 下列化肥属于氮肥的是(?????? )
A.NH4Cl
B.KCl
C.(NH4)2SO4
D.K2SO4
参考答案:AC
本题解析:试题分析:氮肥就是以含有氮元素物质为主的肥料,所以答案为AC;BD为钾肥。
本题难度:一般
4、选择题 为中国近代化学发展做出突出贡献的科学家是
A.李四光
B.华罗更
C.候德榜
D.钱学森
参考答案:B
本题解析:题述四个选项中的科学家均为我国科学事业的发展做出了突出的贡献。其中,李四光是我国当代著名的地质学家;华罗更是著名的数学家;钱学森是著名的物理学家;候德榜被称为中国近代化学史上的第一颗明星,为中国化学工业发展做出卓越贡献,是中国近代化工工业的奠基人,他发明的联合制碱法为中华民族争得了荣誉。
本题难度:简单
5、填空题 (15分)
硫酸工厂排放的尾气中,含少量的二氧化硫。为防止污染大气,在排放前必需进行尾气处理并设法进行综合利用。
⑴硫酸工厂排放尾气中的SO2通常用足量石灰水吸收,然后再用稀硫酸处理。
①写出上述过程的化学反应方程式:?????????????????????????,????????????????????
②请说出这种尾气处理方法的优点(说出两点即可)??????????
③若某硫酸厂每天排放的1万米3。(标准状况)尾气中含0.2%(体积百分数)的SO2,通过上述方法处理,理论上需生石灰???????????kg。
⑵近闻美国和日本正在研究用Na2SO3吸收法作为治理SO2污染的一种新方法,该方法:第一步是用Na2SO3水溶液吸收SO?2,第二步是加热吸收溶液,可得到含高浓度SO2的水蒸气副产品。
这种尾气处理方法与(1)相比的优点是???????????????????????????????。
⑶某研究小组用NaOH溶液吸收尾气中的二氧化硫,将所得的Na2SO3溶液进行电解循环再生,这种新工艺叫再生循环脱硫法;其中阴阳膜组合循环再生机理如图,a、b离子交换膜将电解槽分为三个。区域,电极材料为石墨。?
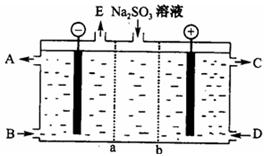
①图中a表示??????????离子交换膜(填“阴”或“阳”)。A—E分别代表生产中的原料或产品,其中C为硫酸,则A表示???,E表示????????????。
②阳极的电极反应式为????????????????????。
参考答案:(1)①SO2+Ca(OH)2=CaSO3↓+H2O(2分)
本题解析:略
本题难度:一般
|