7.0~13.0
(1)KMnO4氧化废水中Mn2+生成MnO2的离子方程式为 ;滤渣I的主要成分除MnO2外,另一种
是 (写化学式)。
(2)滤渣II的主要成分除过量的Zn粉、MnO2外,还有 (写化学式);滤渣II中含有二氧化锰,其可能原因是 。
(3)灼烧生成的碱式碳酸锌[ZnCO3·2Zn(OH)2]的化学方程式为 ;灼烧时,用到的硅酸盐质仪器除酒精灯外还用到的2种是 。
参考答案:(1)3Mn2++2MnO4—+2H2O 本题解析: 本题解析:
试题分析:根据题给工艺流程和信息知,pH=1的原料废水(含Zn2+及少量的Mn2+、Fe2+及Pb2+等)加入高锰酸钾溶液氧化,Mn2+被氧化为MnO2,Fe2+被氧化为Fe3+,调pH为5.2,Fe3+转化为氢氧化铁沉淀,经过滤除去氢氧化铁和二氧化锰的混合物;再向滤液中加锌粉,锌与Pb2+发生置换反应生成锌离子和金属铅,,锌与滤液中剩余的高锰酸钾溶液发生氧化还原反应生成二氧化锰;过滤除去铅和二氧化锰,向滤液中加入碳酸钠粉末与Zn2+发生反应生成生成的碱式碳酸锌[ZnCO3·2Zn(OH)2],经过滤、洗涤、灼烧的氧化锌。(1)KMnO4氧化废水中Mn2+生成MnO2的离子方程式为
3Mn2++2MnO4—+2H2O 5MnO2+4H+;滤渣I的主要成分除MnO2外,另一种是Fe(OH)3; (2)滤渣II的主要成分除过量的Zn粉、MnO2外,还有Pb;滤渣II中含有二氧化锰,其可能原因是“氧化”时加入的KMnO4的量过多,MnO4—被Zn还原产生MnO2; (3)灼烧生成的碱式碳酸锌[ZnCO3·2Zn(OH)2]的化学方程式为ZnCO3·2Zn(OH)2 5MnO2+4H+;滤渣I的主要成分除MnO2外,另一种是Fe(OH)3; (2)滤渣II的主要成分除过量的Zn粉、MnO2外,还有Pb;滤渣II中含有二氧化锰,其可能原因是“氧化”时加入的KMnO4的量过多,MnO4—被Zn还原产生MnO2; (3)灼烧生成的碱式碳酸锌[ZnCO3·2Zn(OH)2]的化学方程式为ZnCO3·2Zn(OH)2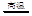 3ZnO+CO2+2H2O;灼烧时,用到的硅酸盐质仪器除酒精灯外还用到的2种是坩埚、玻璃棒、泥三角。 3ZnO+CO2+2H2O;灼烧时,用到的硅酸盐质仪器除酒精灯外还用到的2种是坩埚、玻璃棒、泥三角。
考点:以工业废水制备氧化锌的流程为载体考查离子方程式、化学方程式的书写,物质的分离、提纯和化学实验基本操作。
本题难度:一般
2、选择题 已知:25℃时,KSP[Mg( OH)2] =5.61× 10-12,Ksp[MgF2]=7.42×10-11。下列说法正确的是[???? ]
A. 25℃时,饱和Mg( OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B. 25℃时,在Mg( OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
C. 25℃时,Mg( OH)2固体在20 mL 0.0l moI/L氨水中的Ksp比在20 mL 0.01mol/LNH4Cl溶液中的Ksp小
D.25℃时,在Mg( OH)2悬浊液中加入NaF溶液后,Mg( OH)2不可能转化为MgF2
参考答案:B
本题解析:
本题难度:简单
3、选择题 向一定体积的饱和石灰水中加入少量生石灰,并恢复到原状况。则下列叙述正确的是
A.溶液的pH增大
B.溶液的pH减小
C.溶液中Ca2+浓度保持不变
D.溶液中Ca2+物质的量保持不变
参考答案:C
本题解析:
正确答案:C
向一定体积的饱和石灰水中加入少量生石灰,并恢复到原状况,发生CaO+H2O=Ca(OH)2 ,溶液中水减少,Ca(OH)2减少析出,溶液仍饱和。A、B应为溶液的pH不变;D.溶液中Ca2+物质的量应减少。
本题难度:简单
4、填空题 水体中重金属铅的污染问题备受关注。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、
Pb(OH)3-、Pb(OH)42-。各形态的浓度分数α随溶液pH 变化的关系如图所示:【图中1表示Pb2+,2表示
Pb(OH)+,3表示Pb(OH)2,4表示Pb(OH)3-,5表示Pb(OH)42-】
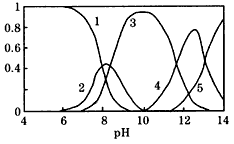
(l)Pb(NO3)2溶液中, ______2(填“>”、“=”或“<”);往该溶液中滴入氯化铵溶液后, ______2(填“>”、“=”或“<”);往该溶液中滴入氯化铵溶液后,
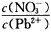 增加,可能的原因是___________________ 增加,可能的原因是___________________
(2)往Pb(NO3)2溶液中滴稀NaOH溶液,pH=8时溶液中存在的阳离子(Na+除外)有___________,pH=9时,主要反应的离子方程式为_______________________。
(3)某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如下表:
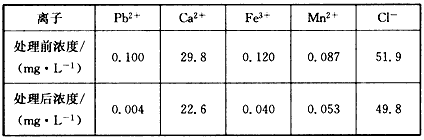
上表中除Pb2+外,该脱铅剂对其他离子的去除效果最好的是_________。
(4)如果该脱铅剂(用EH表示)脱铅过程中主要发生的反应为:2EH(s)+Pb2+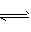 E2Pb(s) +2H+。则脱铅的最合适pH 范围为___(填代号)。 E2Pb(s) +2H+。则脱铅的最合适pH 范围为___(填代号)。
A.4 ~5
B.6 ~7
C.9~10
D.11~12
参考答案:(1)>;Pb2+与Cl-发生反应生成PdCl2沉淀,
本题解析:
本题难度:一般
5、选择题 已知锌及其化合物的性质与铝及其化合物相似。如图,横坐标为溶液的pH,纵坐标为Zn2+离子或
[Zn(OH)4]2-离子的物质的量浓度(假设Zn2+离子浓度为10-5mol·L-1时,Zn2+离子已沉淀完全)。下列说法不正确的是
 [???? ] [???? ]
A.往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为:Zn2++4OH-=[Zn(OH)4]2-
B.从图中数据计算可得Zn(OH)2的溶度积Ksp=10-17
C.某废液中含Zn2+离子,沉淀Zn2+离子可以控制溶液pH的范围是8~12
D.向1L 1 mol·L-1ZnCl2溶液中加入NaOH固体至pH=6,需NaOH 0.2mol
参考答案:D
本题解析:
本题难度:一般
|