微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示,下列说法中不正确的是

A.b点对应的Ksp等于c点对应的Ksp
B.采取蒸发溶剂的方法可以使溶液从a点变到b点
C.该温度下,Ag2SO4的溶度积常数(Ksp)为1.6×10-5(mol·L-1)2
D.0.02mol·L-1的AgNO3溶液与的0. 2mol·L-1的Na2SO4溶液等体积混合不会生成沉淀
参考答案:B
本题解析:
蒸发的过程中,Ag+和硫酸根离子浓度均将增大,因而不会水平变化,故B说法错误。
本题难度:一般
2、填空题 天然气(主要成分甲烷)是一种清洁、高效的能源,现在许多城市家庭用于厨房使用的燃料已经由煤气(主要成分是H2和CO按体积比1:1混合的气体混合物)换成了天然气;此外天然气也是很好的燃料电池的燃料,甲烷在燃料电池中的能量转换率可达到85%~90%。
请回答下列问题:
(1)已知H2、CO和CH4的燃烧热分别是286kJ/mol、283kJ/mol和890kJ/mol,则反应:2CH4(g)+3O2(g)= CO(g)+H2(g)+CO2(g)+3H2O(l)的反应热△H=____________
(2)以甲烷、空气为反应物,KOH溶液作电解质溶液构成燃料电池,则负极反应式为__________________。随着反应的不断进行溶液的pH______(填“增大”“减小”或“不变”)
(3)如果以该燃料电池为电源、石墨作两电极电解饱和食盐水,则该电解过程中阳极反应式为__________;如果电解一段时间后NaCl溶液的体积为1L,溶液的pH为12,则理论上消耗甲烷在标准状况下的体积为_________mL。
(4)将(3)中电解结束后的溶液取出,向其中加入含有Mg2+和Fe2+的溶液甲,Mg(OH)2和Fe(OH)2同时生成,已知Mg(OH)2和Fe(OH)2在该温度下的溶度积常数分别是2× 10-11和8×10-16,则甲溶液中Mg2+和Fe2+的浓度比为___。
参考答案:(1)-1211kJ/mol
(2)CH4+10OH
本题解析:
本题难度:一般
3、选择题 将足量BaCO3(Ksp=8.1×10-9) 分别加入:①30mL 水 ②10mL 0.2mol/LNa2CO3溶液③50mL 0.01mol/L 氯化钡溶液 ④100mL 0.01mol/L盐酸中溶解至溶液饱和。请确定各溶液中Ba2+的浓度由大到小的顺序为 [???? ]
A.①②③④
B.③④①②
C.④③①②
D.②①④③
参考答案:B
本题解析:
本题难度:一般
4、选择题 室温时,M(OH)2(s)  M2+(aq)+2OH-(aq) Ksp=a; c(M2+)="b" mol · L -1时,溶液的pH等于
M2+(aq)+2OH-(aq) Ksp=a; c(M2+)="b" mol · L -1时,溶液的pH等于
A.
B.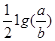
C.14+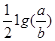
D.14+
参考答案:C
本题解析:
试题分析:室温时,M(OH)2(s)?M2+(aq)+2OH-(aq),依据Ksp=c(M2+)c2(OH-)及Ksp=a,C(M2+)="b" mol?L-1,则c(OH-)=Ksp/ C(M2+)=a/bmol?L-1,所以c(H+)=" Kw/" c(OH?)=10?14/(a÷b)mol?L-1,则pH=-lgc(H+)=14+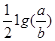 ,答案为C。
,答案为C。
考点:考查难溶电解质的溶解平衡及沉淀转化的本质,PH值的简单计算。
本题难度:一般
5、选择题 下列说法不正确的是(???)
A.Ksp只与难溶电解质的性质和温度有关
B.由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀
C.其他条件不变,离子浓度改变时,Ksp不变
D.两种难溶电解质作比较时,Ksp小的溶解度一定小
参考答案:D
本题解析:
试题分析:两种难溶电解质作比较时,结构相同的,Ksp小的溶解度一定小。不同的无可比性。故D项错误。
本题难度:一般