微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)氧化锌是重要的基础化工原料,从含锌废水(含Zn2+及少量的Mn2+、Fe2+及Pb2+等)为原料制取ZnO的实验流程如下:

已知几种难溶氢氧化物沉淀的PH范围
氢氧化物
| Fe(OH)3
| Fe(OH)2
| Zn(OH)2
| Pb(OH)2
|
pH
| 2.2~3.2
| 5.8~7.9
| 5.5~13.5
| 7.0~13.0
(1)KMnO4氧化废水中Mn2+生成MnO2的离子方程式为 ;滤渣I的主要成分除MnO2外,另一种
是 (写化学式)。
(2)滤渣II的主要成分除过量的Zn粉、MnO2外,还有 (写化学式);滤渣II中含有二氧化锰,其可能原因是 。
(3)灼烧生成的碱式碳酸锌[ZnCO3·2Zn(OH)2]的化学方程式为 ;灼烧时,用到的硅酸盐质仪器除酒精灯外还用到的2种是 。
2、选择题 已知:25℃时,KSP[Mg( OH)2] =5.61× 10-12,Ksp[MgF2]=7.42×10-11。下列说法正确的是[???? ]
A. 25℃时,饱和Mg( OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B. 25℃时,在Mg( OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
C. 25℃时,Mg( OH)2固体在20 mL 0.0l moI/L氨水中的Ksp比在20 mL 0.01mol/LNH4Cl溶液中的Ksp小
D.25℃时,在Mg( OH)2悬浊液中加入NaF溶液后,Mg( OH)2不可能转化为MgF2
3、选择题 向一定体积的饱和石灰水中加入少量生石灰,并恢复到原状况。则下列叙述正确的是
A.溶液的pH增大
B.溶液的pH减小
C.溶液中Ca2+浓度保持不变
D.溶液中Ca2+物质的量保持不变
4、填空题 水体中重金属铅的污染问题备受关注。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、
Pb(OH)3-、Pb(OH)42-。各形态的浓度分数α随溶液pH 变化的关系如图所示:【图中1表示Pb2+,2表示
Pb(OH)+,3表示Pb(OH)2,4表示Pb(OH)3-,5表示Pb(OH)42-】
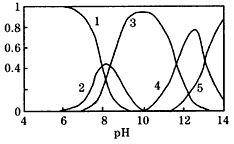
(l)Pb(NO3)2溶液中, ______2(填“>”、“=”或“<”);往该溶液中滴入氯化铵溶液后, ______2(填“>”、“=”或“<”);往该溶液中滴入氯化铵溶液后,
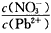 增加,可能的原因是___________________ 增加,可能的原因是___________________
(2)往Pb(NO3)2溶液中滴稀NaOH溶液,pH=8时溶液中存在的阳离子(Na+除外)有___________,pH=9时,主要反应的离子方程式为_______________________。
(3)某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如下表:
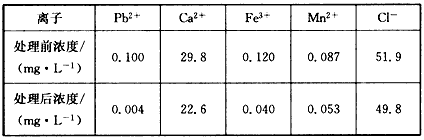
上表中除Pb2+外,该脱铅剂对其他离子的去除效果最好的是_________。
(4)如果该脱铅剂(用EH表示)脱铅过程中主要发生的反应为:2EH(s)+Pb2+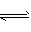 E2Pb(s) +2H+。则脱铅的最合适pH 范围为___(填代号)。 E2Pb(s) +2H+。则脱铅的最合适pH 范围为___(填代号)。
A.4 ~5
B.6 ~7
C.9~10
D.11~12
5、选择题 已知锌及其化合物的性质与铝及其化合物相似。如图,横坐标为溶液的pH,纵坐标为Zn2+离子或
[Zn(OH)4]2-离子的物质的量浓度(假设Zn2+离子浓度为10-5mol·L-1时,Zn2+离子已沉淀完全)。下列说法不正确的是
 [???? ] [???? ]
A.往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为:Zn2++4OH-=[Zn(OH)4]2-
B.从图中数据计算可得Zn(OH)2的溶度积Ksp=10-17
C.某废液中含Zn2+离子,沉淀Zn2+离子可以控制溶液pH的范围是8~12
D.向1L 1 mol·L-1ZnCl2溶液中加入NaOH固体至pH=6,需NaOH 0.2mol
|