微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用NA表示阿伏加德罗常数,下列的叙述正确的是(??? )
A.在2 L 0.15 mol·L-1 K2SO4溶液中,含有K+和 的总数为0.9NA
的总数为0.9NA
B.在标准状况下46 g NO2含有NA个分子
C.a g某气体含有分子数为b,则c g该气体在标准状况下的体积是22.4bc/aNA L
D.当稀硝酸跟5.6 g Fe反应完全时,电子转移一定是0.3NA
参考答案:AC
本题解析:A中含0.3 mol K2SO4,1 mol K2SO4含2 mol K+,含1 mol  ,所以A正确。B项中存在2NO2
,所以A正确。B项中存在2NO2 本题难度:简单
本题难度:简单
2、选择题 将一块铁片放入500mL,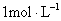 的
的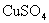 溶液中,反应一段时间后,取出铁片,小心洗净后干燥称量,铁片增重0.8g,反应后溶液中
溶液中,反应一段时间后,取出铁片,小心洗净后干燥称量,铁片增重0.8g,反应后溶液中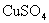 的物质的量浓度是( )
的物质的量浓度是( )
A.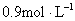
B.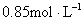
C.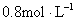
D.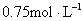
参考答案:C
本题解析:考查挖掘关系量及缜密思维能力。
解题思路:以方程式挖掘新的关系量,先求反应的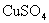
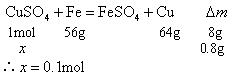
剩余
本题难度:简单
3、选择题 有Mg、Al、Fe、Cu四种金属,若两两混合,取混合物26 g与足量稀硫酸反应产生标准状况下氢气11.2 L,则此混合物的可能组合最多有
A.2种
B.3种
C.4种
D.5种
参考答案:C
本题解析:
试题分析:混合物26 g与足量稀硫酸反应,产生标况下H2 11.2 L,氢气物质的量="11.2/22.4=0.5" mol,26 g金属提供电子物质的量为0.5 mol×2="1" mol,提供1 mol电子需要金属的平均质量为26 g,Mg在反应中表现+2价,提供1 mol电子需要Mg的质量为24 g×1/2="12" g,Al在反应中表现+3价,提供1 mol电子需要Al的质量为27 g×1/3="9" g,Fe在反应中表现+2价,提供1 mol电子需要Fe的质量为56 g×1/2="28" g,
Cu不稀硫酸反应产生氢气,提供1 mol电子需要Cu的质量为无穷大,两两混合,可能的组合为Cu与Mg、Cu与Al、Fe与Mg、Fe与Al,共4种,选C。
考点:考查金属与酸的反应。
本题难度:一般
4、选择题 下列实验能达到目的是( )
A.在容量瓶中加入一定体积的水,再加入浓硫酸配制准确浓度的稀硫酸
B.可溶于水的固体与难溶于水的固体形成的混合物可用溶解、过滤、蒸发的方法分离
C.用玻璃棒搅拌漏斗中的液体以加快过滤速度
D.加入盐酸以除去硫酸钠中的少量碳酸钠杂质
参考答案:A、容量瓶不能做为稀释仪器,是定容仪器,稀释浓硫酸必须在烧杯
本题解析:
本题难度:简单
5、选择题 设NA代表阿伏加德罗常数的数值,下列说法正确的是:
A.10 mL 20 mol·L-1浓硫酸与足量锌反应,转移电子数为0.2NA
B.0.1 mol24Mg18O晶体中所含中子总数为2.0 NA
C.在标准状况下,2.8g N2和2.24L CO所含电子数均为1.4NA
D.1 L 1 mol·L-1的NaClO溶液中含有ClO-的数目为NA
参考答案:C
本题解析:
试题分析:A、因为浓硫酸与锌反应生成二氧化硫气体,随反应的进行,浓硫酸逐渐变为稀硫酸,稀硫酸与锌反应产生氢气,所以转移电子数不能确定,错误;B、24Mg18O中的中子数是24-12+18-8=22,所以0.1mol24Mg18O晶体中所含中子总数为2.2 NA,错误;C、标准状况下2.24LCO的物质的量是0.1mol,2.8g氮气的物质的量也是0.1mol,二者分子中的电子数都是14,所以0.1mol分子中含有电子数是1.4NA,正确;D、次氯酸根离子水解,使溶液中次氯酸根离子数目小于NA,错误,答案选C。
考点:考查阿伏伽德罗常数与微粒数的关系
本题难度:一般