微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 (1)某学习小组利用下图装置制取氯气并探究其性质。
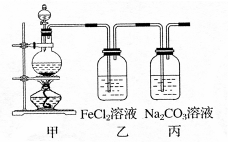
①甲装置中反应的化学方程式是?????????????????????????????????????;
②证明乙装置中FeCl2溶液与Cl2发生了反应的实验方法是(只注明试剂、现象)??????????????????????????????????????????????????????????;
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质。已知碳酸的酸性强于次氯酸,则丙中反应的化学方程式是????????????????????????????????????。
(2)有一瓶长期放置的漂白粉,请利用以下仪器和试剂,完成该漂白粉成份的探究。
试管、胶头滴管、带导管的单孔塞、蒸馏水、1mol·L-1盐酸、品红溶液、新制澄清石灰水。
【提出假设】假设一:该漂白粉未变质,含CaCl2、Ca(ClO)2;
假设二:该漂白粉全部变质,含????????????????;
假设三:该漂白粉部分变质,含CaCl2、Ca(ClO)2、CaCO3 。
【进行实验】在答题卡上完成下表(不必检验Ca2+、Cl-):
实验步骤
| 预期现象和结论
|
①
| 用A试管取少量澄清石灰水备用,用B试管取少量样品,再向B试管???????????????????????????
???????????????????????????????????????????
???????????????????????????????????????????
| 若无气体放出且澄清石灰水未见浑浊,则假设一成立;??????????????????????????????
??????????????????????????????????????
??????????????????????????????????????
|
②
| ???????????????????????????????????????????
???????????????????????????????????????????
???????????????????????????????????????????
| ???????????????????????????????????????????
???????????????????????????????????????
???????????????????????????????????????????????
?
2、填空题 硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 、MgO等,部分生产工艺流程图示意如下:
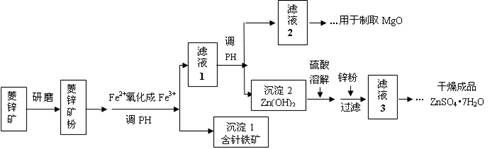
(1)将菱锌矿研磨成粉的目的是????????????????????????。
(2)工业流程中必须将Fe2+氧化成Fe3+后再加以分离。在实验室中可以用H2O2,在酸性条件下完成这个转化,请写出相应的离子方程式:
???????????????????????????????????????????????????????。
(3)针铁矿的组成元素是Fe、O和H,化学式量为89,化学式是?????????。
(4)工业上从“滤液2”制取MgO过程中,合适的反应物是 ??????????(选填序号)。
a.大理石粉?????? b.石灰乳?????? c.纯碱溶液??????? d.烧碱溶液
(5)“滤液3”之后的操作依次为 ??????????、 ??????????、过滤,洗涤,干燥。
3、实验题 某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表。请从下表中实验现象(II)(填A、B、C……)中选出与实验方案(I)(填1、2、3……)对应的实验现象,填入答案(III)中。
实验方案(I)
| 实验现象(II)
| 答案(III)
| I
| II
| 1.用砂纸擦后的镁带与沸水反应,再向反应液中滴加酚酞
| A.浮与水面,剧烈反应,放出气体,熔成一个小球,在水面上无定向移动,随之消失,溶液变红色。
| 1
| ?
| 2.向新制的H2S饱和溶液中滴加新制的氯水
| B.产生大量气体,可在空气中燃烧,溶液变成浅红色
| 2
| ?
| 3.钠与滴有酚酞的冷水反应
| C.反应不十分剧烈,产生的气体可以在空气中燃烧
| 3
| ?
| 4.镁带与2mol/L的盐酸反应
| D.剧烈反应,产生的气体可以在空气中燃烧
| 4
| ?
| 5.铝条与2mol/L的盐酸反应
| E.生成白色絮状沉淀,继而沉淀消失
| 5
| ?
| 6.向AlCl3溶液中滴加NaOH溶液至过量
| F.生成淡黄色沉淀
| 6
|
通过以上实验分析了同周期的哪些元素(填元素符号)________________,从实验结果可以得出的结论是______________________________________。
4、填空题 (16分)黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取的主要原料。某化学学习小组对黄铁矿石进行如下实验探究:
[实验一]为测定硫元素的含量
I.将m1g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。
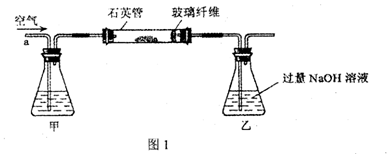
II.反应结束后,将乙瓶中的溶液进行如图2处理。

[实验二]测定铁元素的含量。III。测定铁元素含量的实验步骤如下:
①用足量稀硫酸溶解石英管中的固体残渣;
②加还原剂使溶液中的Fe3+完全转化为Fe2+后,过滤、洗涤;
③将滤液稀释至250mL;
④每次取稀释液25.00mL,用已知物质的量浓度为cmol/L的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为VmL(该反应中还原产物为Mn2+)
请完成下列填空:
(1)已知12gFeS2完全燃烧放热85.3kJ,则FeS2燃烧热的化学方程式是??????????。
(2)I中,甲瓶内所盛试剂是????????溶液;乙瓶内发生反应的离子方程式有?????;I中玻璃纤维的作用是?????????????。
(3)II中,所加H2O2溶液需足量的理由是????????????。
(4)III的步骤③中,需要用到的仪器除烧杯、玻璃棒外,还有??????????;
(5)该黄铁矿中硫元素的质量分数?????????(用I、II中有关实验数据表达);该黄铁矿中铁的元素的质量分数?????????(用I、II中有关实验数据表达)
5、填空题 钛(Ti)被称为继铁、铝之后的第三金属,钛白(TiO2)是目前最好的白色颜料.制备TiO2和Ti的原料是钛铁矿,我国的钛铁矿储量居世界首位.含有Fe2O3的钛铁矿(FeTiO3)制取TiO2的流程如下:
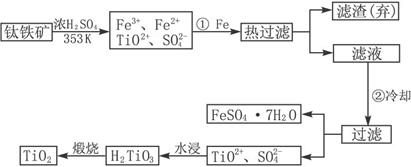
(1)Ti的原子序数为22,Ti位于元素周期表中第______周期,第______族.
(2)步骤①加Fe的目的是______;步骤②冷却的目的是______.
(3)上述制备TiO2的过程中,可以利用的副产物是______;考虑成本和废物综合利用因素,废液中应加入______处理.
(4)由金红石(TiO2)制取单质Ti,涉及到的步骤为:已知:
①C(s)+O2(g)=CO2(g);△H=-393.5kJ?mol-1
②2CO(g)+O2(g)=2CO2(g);△H=-566kJ?mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g);△H=+141kJ?mol-1则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H=______.反应TiCl4+2Mg=2MgCl+Ti?在Ar气氛中进行的理由是______.
|
|