微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组离子在溶液中可大量共存的是
A.K+,Cl—,CO32-,Na+
B.H+,Ba2+,Fe 3+,S2-
C.NH4+,SO42-,K+,OH-
D.H +,NO3-,Na+,SiO32-
参考答案:A
本题解析:在溶液中离子之间不发生反应,则能大量共存,否则不能大量共存。B中Fe 3+能氧化S2-不能大量共存,C中NH4+和OH-发生复分解反应,不能大量共存,D中H +和SiO32--发生复分解反应,不能大量共存,所以答案是A。
本题难度:一般
2、选择题 乙烷在光照条件下与氯气发生取代反应,理论上得到的氯代物最多有几种
A.8
B.6
C.5
D.9
参考答案:D
本题解析:此题针对同分异构体知识点的考察。乙烷的分子式为C2H6,若分子上的所有的H原子依次被氯原子取代,则可得氯代物6种。但考虑同分异构现象,其中二氯代物、三氯代物、四氯代物各有2种同分异构体,所以最多共有9种氯代物,故答案D。
本题难度:简单
3、选择题 以下反应不属于“同一价态的同种元素既被氧化又被还原”的是
A.硫代硫酸钠与稀硫酸
B.硫与热NaOH溶液
C.H2O2溶液中加入MnO2
D.KClO3与盐酸
参考答案:D
本题解析:
试题分析:A.硫代硫酸钠与稀硫酸反应为硫代硫酸钠中+2价S部分被还原为0价、部分被氧化为+4价,属于“同一价态的同种元素既被氧化又被还原”,故A不正确。B.硫与热NaOH溶液反应为0价S部分被还原为-2价、部分被氧化为+4价,属于“同一价态的同种元素既被氧化又被还原”,故B不正确。C. 溶液中加入MnO2,H2O2分生成解其中-1价O部分被还原-2价、部分被氧化为0价,属于“同一价态的同种元素既被氧化又被还原”,故C不正确。D.KClO3与盐酸反应为KClO3中+5价Cl与HCl中-1价Cl生成0价的Cl2。故D正确。
考点:了解氧化还原反应的本质是电子的转移。了解常见的氧化还原反应。
点评:本题考查氧化还原反应的类型,特别是歧化反应与归中反应。氧化还原反应中同种元素价态变化的规律为同“可分可合,不交叉”,化合价“分”即为歧化反应,化合价“合”即为归中反应。
本题难度:一般
4、选择题 用石墨作电极,电解CuSO4溶液,一段时间后,阴极上只析出铜,要恢复到原浓度,应向溶液中加入
A.Cu(OH) 2
B.Cu
C.CuSO4
D.CuO
参考答案:D
本题解析:电解什么物质加入什么物质,电解CuSO4溶液析出铜产生氧气,加入氧化铜。
本题难度:简单
5、选择题 利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。下列说法不正确的是
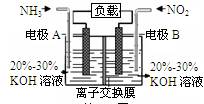
A.电流从右侧电极经过负载后流向左侧电极
B.A电极上发生氧化反应,B为正极
C.电极A极反应式为2NH3-6e-=N2+6H+
D.当有2.24LNO2(标准状况) 被处理时,转移电子为0.4mol
参考答案:C
本题解析:
试题分析:A、根据电池反应的化学方程式可知氨气中N元素的化合价升高,被氧化,所以通入氨气的一极为负极,则右端为正极,所以电流从右侧电极经过负载后流向左侧电极,正确;B、A为负极,发生氧化反应,B是正极,发生还原反应,正确;C、电极A发生的反应是氨气失去电子生成氮气,因为电解质溶液为KOH溶液,所以氨气失去电子与氢氧根离子结合为水,电极反应式是2NH3-6e-+6OH-=N2+6H2O,错误;D、标准状况下2.24L二氧化氮的物质的量是0.1mol,N元素的化合价从+4价降低到0价,得到4个电子,则0.1mol二氧化氮参加反应时得到0.4mol电子,即转移电子的物质的量是0.4mol,正确,答案选C。
考点:考查电化学反应原理的应用
本题难度:困难