微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是(??)
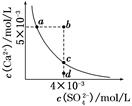
A.在任何溶液中,c(Ca2+)、c(SO42-)均相等
B.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3 mol/L
C.a点对应的Ksp等于c点对应的Ksp
D.d点溶液通过蒸发可以变到c点
2、选择题 已知Ksp(AgCl)=1.8×10—10mol2?L—2,Ksp(AgI)=1.0×10—16mo2?L—2。下列说法错误的是
A.AgCl不溶于水,不能转化为AgI
B.在含浓度均为0.001mol?L—1的Cl—、I—的溶液中缓慢滴AgNO3稀溶液,先析出AgI
C.AgI比AgCl更难溶于水,所以AgCl可转化为AgI
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于 ×10—11mol?L—1
×10—11mol?L—1
3、选择题 在一定温度下,当Mg(OH)2固体在水溶液中达到下列平衡时:Mg(OH)2 Mg2++2OH-,要使Mg(OH)2固体减少而c(Mg2+)不变,可采取的措施是???????? ( )
Mg2++2OH-,要使Mg(OH)2固体减少而c(Mg2+)不变,可采取的措施是???????? ( )
A.加MgSO4
B.加HCl溶液
C.加NaOH
D.加少量水
4、选择题 海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案
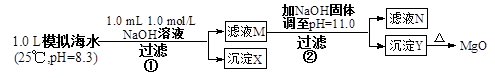
模拟海水中的
离子浓度(mol/L)
| Na+
| Mg2+
| Ca2+
| Cl―
| 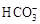
|
0.439
| 0.050
| 0.011
| 0.560
| 0.001
注:溶液中某种离子的浓度小于1.0×10-5 mol/L,可认为该离子不存在;
实验过程中,假设溶液体积不变。
已知:Ksp(CaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;
Ksp[Ca(OH)2]=4.68×10-6;Ksp[Mg(OH)2]=5.61×10-12。
下列说法正确的是(???)
A.沉淀物X为CaCO3
B.滤液M中存在Mg2+,不存在Ca2+
C.滤液N中存在Mg2+、Ca2+?????????
D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物
5、选择题 下表是五种银盐的溶度积常数(25℃)。下列说法错误的是
 [???? ] [???? ]
A.五种物质在常温下溶解度最小的是Ag2S
B.向AgCl悬浊液中加入Na2S,则可以生成黑色沉淀
C.氯化银、溴化银和碘化银三种物质在常温下的溶解度依次增大
D.难溶电解质的溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动
|