微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是(??)
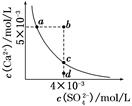
A.在任何溶液中,c(Ca2+)、c(SO42-)均相等
B.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3 mol/L
C.a点对应的Ksp等于c点对应的Ksp
D.d点溶液通过蒸发可以变到c点
参考答案:C
本题解析:A项只有在单一CaSO4溶液中c(Ca2+)、c(SO42-)才相等,A项错误;B项b点Qc>Ksp,故有沉淀生成,开始c(Ca2+)、c(SO42-)不相等而反应消耗的Ca2+、SO42-相等,因此平衡后的两种离子也不会都等于3×10-3 mol/L,B项错误;在平衡线上的Ksp均相等,C项正确;D项d点通过蒸发后各离子浓度都增大,不可能保持SO42-浓度不变而到达c点,D项错误。
本题难度:一般
2、选择题 已知Ksp(AgCl)=1.8×10—10mol2?L—2,Ksp(AgI)=1.0×10—16mo2?L—2。下列说法错误的是
A.AgCl不溶于水,不能转化为AgI
B.在含浓度均为0.001mol?L—1的Cl—、I—的溶液中缓慢滴AgNO3稀溶液,先析出AgI
C.AgI比AgCl更难溶于水,所以AgCl可转化为AgI
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于 ×10—11mol?L—1
×10—11mol?L—1
参考答案:A
本题解析:
试题分析:A、Ksp(AgCl)>Ksp(AgI)>0,说明难溶于水的AgCl可以转化为更难溶的AgI,错误;B、由于Ksp(AgCl)>Ksp(AgI),因此优先析出AgI沉淀,正确;C、Ksp(AgCl)>Ksp(AgI),说明AgI比AgCl更难溶于水,则AgCl可以转化为AgI,正确;D、AgCl(s) 本题难度:一般
本题难度:一般
3、选择题 在一定温度下,当Mg(OH)2固体在水溶液中达到下列平衡时:Mg(OH)2 Mg2++2OH-,要使Mg(OH)2固体减少而c(Mg2+)不变,可采取的措施是???????? ( )
Mg2++2OH-,要使Mg(OH)2固体减少而c(Mg2+)不变,可采取的措施是???????? ( )
A.加MgSO4
B.加HCl溶液
C.加NaOH
D.加少量水
参考答案:D
本题解析:MgSO4易溶于水,加MgSO4会增加c(Mg2+),A错误;加HCl溶液会中和OH-平衡右移,使c(Mg2+)增大,B错误;加NaOH使c(OH-)增大平衡左移,c(Mg2+)减小,C错误;加少量水时c(Mg2+)减少,平衡右移重新达到平衡时,c(Mg2+)又与原平衡相同,D正确。
本题难度:一般
4、选择题 海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案
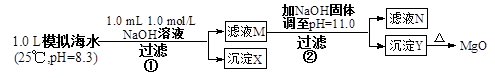
模拟海水中的
离子浓度(mol/L)
| Na+
| Mg2+
| Ca2+
| Cl―
| 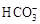
|
0.439
| 0.050
| 0.011
| 0.560
| 0.001
注:溶液中某种离子的浓度小于1.0×10-5 mol/L,可认为该离子不存在;
实验过程中,假设溶液体积不变。
已知:Ksp(CaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;
Ksp[Ca(OH)2]=4.68×10-6;Ksp[Mg(OH)2]=5.61×10-12。
下列说法正确的是(???)
A.沉淀物X为CaCO3
B.滤液M中存在Mg2+,不存在Ca2+
C.滤液N中存在Mg2+、Ca2+?????????
D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物
参考答案:A
本题解析:步骤①发生Ca2++OH-+ HCO3-="==" CaCO3↓+H2O;步骤②:Ksp[Mg(OH)2]=c(Mg2+)×(10-3)2=5.6×10-12,c(Mg2+)=5.6×10-6。Q[Ca(OH)2]=c(Ca2+)×(10-3)2=10-8<Ksp,无Ca(OH)2析出。A选项正确,生成0001 mol CaCO3。B选项错误,剩余c(Ca2+)=0.001 mol/L。C选项错误,c(Mg2+)=5.6×10-6<10
本题难度:一般
5、选择题 下表是五种银盐的溶度积常数(25℃)。下列说法错误的是
 [???? ] [???? ]
A.五种物质在常温下溶解度最小的是Ag2S
B.向AgCl悬浊液中加入Na2S,则可以生成黑色沉淀
C.氯化银、溴化银和碘化银三种物质在常温下的溶解度依次增大
D.难溶电解质的溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动
参考答案:C
本题解析:
本题难度:一般
|