微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知某温度下AgCl(s)的溶度积常数Ksp=1×10-10.在该温度下,向50mL?0.018mol/L的AgNO3溶液中加入50mL?0.02mol/L的盐酸,生成沉淀(混合后溶液的体积变化忽略不计).下列说法正确的是( )
A.AgCl的溶解性为难溶,则该物质不溶于水
B.沉淀生成后,溶液中Ag+的浓度1×10-5?mol/L
C.沉淀生成后,溶液的pH为2
D.沉淀生成后,溶液中NO3-的浓度1.8×10-2?mol/L
参考答案:A.AgCl的溶解性为难溶,则该物质的溶解性很小,绝对不溶于
本题解析:
本题难度:简单
2、填空题 (6分)某种工业废水中含有一定量的Cr2O72-和CrO42-,它们易被人体吸收积累而导致肝癌。污水处理厂常用还原沉淀法处理含铬废水,其流程如下:
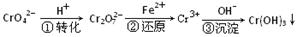
(1)已知第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
①Cr2O72-中Cr的化合价是?????????。
②若平衡体系的pH=10,则溶液显???????????色。
(2)第②步发生反应的离子方程式为?? _______?????????????,还原1mol Cr2O72—离子,需要_______mol的FeSO4·7H2O;
(3)常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至?????????。
参考答案:(1)① +6 (1分)?②黄(1分)
(2)6Fe2
本题解析:(1)①根据化合价的代数和为0可知,Cr的化合价是+(2×7-2)÷2=+6价。
②pH=10,说明溶液显碱性,平衡向逆反应方向移动,所以溶液显黄色。
(2)根据反应物可知,亚铁离子被氧化生成铁离子,所以方程式为6Fe2++ Cr2O72- + 14H+= 6Fe3++ 2Cr3+ + 7H2O。根据方程式可知,还原1mol Cr2O72—离子,需要6mol亚铁离子。
(3)根据溶度积常数表达式可知c(OH-)= 本题难度:一般
本题难度:一般
3、选择题 牙齿表面覆盖的牙釉质是人体中最坚硬的部分,起着保护牙齿的作用,其主要成分为羟基磷酸钙[Ca5(PO4)3OH].在牙齿表面存在着如下平衡:Ca5(PO4)3OH(s)?5Ca2+(aq)+3PO43-(aq)+OH-(aq)Ksp=6.8×10-37mol9?L-9,下列说法错误的是( )
A.残留在牙齿上的糖发酵会产生H+,经常吃糖易造成龋齿
B.由上述平衡可知,小孩长牙时要少吃糖多补钙
C.若减小OH-的浓度,上述平衡将向右移动,Ksp的值相应增大
D.使用含氟牙膏能防止龋齿,是因为Ca5(PO4)3OH(s)转化为更难溶的Ca5(PO4)3F(s)[Ca5(PO4)3F(s)的Ksp=2.8×10-61mol9?L-9]
参考答案:A、残留在牙齿上的糖发酵会产生H+,和沉淀溶解平衡中的氢氧根
本题解析:
本题难度:一般
4、简答题 (1)已知常温下,AgBr的Ksp=4.9×10-13、AgI的Ksp=8.3×10-17.现向含有AgI的饱和溶液中:
①加入固体AgNO3,则c(I-)______(填“变大”、“变小”或“不变”,下同).
②若改加更多的AgI固体,则c(I-)______,而c(Ag+)______.
③若改加AgBr固体,则c(I-)______,而c(Ag+)______.
(2)难溶弱电解质在水溶液中既存在溶解平衡又存在电离平衡.已知Cu(OH)2?Cu2++2OH-,KSP=c(Cu2+)?[c(OH-)]2=2×l0-20.当溶液中各离子浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解.某
CuSO4溶液里c(Cu2+)=0.02mol?L-1,如要生成Cu(OH)2沉淀,应调整沉淀pH使之大于______.
参考答案:(1)①加入AgNO3固体,使c(Ag+)增大,AgI溶解平
本题解析:
本题难度:一般
5、选择题 某混合溶液中含有KCl、 KBr、 K2CrO4, 其浓度均为0.01mol·L-1, 向溶液中逐滴加入0.01mol·L-1AgNO 3溶液时,最先和最后沉淀的物质分别是(AgCl 、AgBr 、Ag2CrO4的 Ksp分别为1.77 ×10-1 0、 5.35×1 0-1 3、1.12×1 0-1 2)
A.AgBr 、AgCl
B.Ag2CrO4、AgCl
C.AgBr 、Ag2CrO4
D.同时沉淀
参考答案:C
本题解析:
试题分析:KCl、KBr、K2CrO4浓度均为0.01mol·L-1,向溶液中逐滴加入 0.01mol·L-1AgNO3溶液时产生AgCl 、AgBr 、Ag2CrO4沉淀所需的c(Ag+)分别为:c(Ag+)=Ksp(AgCl)/c(Cl-)="1.77" ×10-1 0/0.01="1.77" ×10- 8 mol·L-1,c(Ag+)=Ksp(AgBr)/c(Br-)="5.35×1" 0-1 3/0.01="5.35×1" 0-1 1mol·L-1,c2(Ag+)=Ksp(Ag2CrO4)/c(CrO42-)="1.12×1" 0-1 2/0.01,c,(Ag+)="1.0×1" 0-5mol·L-1,可以看出AgBr沉淀时c(Ag+)最小,所以AgBr先沉淀,Ag2CrO4沉淀的c(Ag+)最大,Ag2CrO4最后沉淀,选C。
考点:溶度积的有关计算
本题难度:一般