微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 取 1molA和a molB,按 A(气)+aB(气)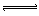 bC(气)进行反应,当A的转化率为50%时,同温同压下,测得混合气体的密
bC(气)进行反应,当A的转化率为50%时,同温同压下,测得混合气体的密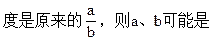
A.a=2,b=1
B.a=3,b=3
C.a=3,b=2
D.a=2,b=3
参考答案:C
本题解析:A(气) + aB(气)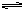 bC(气)?总
bC(气)?总
起始时物质的量(mol) ??????1??? a?????? 0????? 1+a
转化的物质的量(mol) ??????0.5? 0.5a??? 0.5b
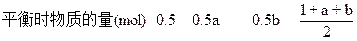

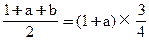
2b-a=1
讨论: 当a=1时,b=1,合理;
当a=2时,b=1.5,不合理;
当a=3时,b=2,合理;
当a>3时,选项中无。
本题难度:一般
2、实验题 (14分)在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+ O2 (g)  ?2SO3(g) △H< 0。查阅资料知SO3熔点16.83℃,沸点44.8℃。
?2SO3(g) △H< 0。查阅资料知SO3熔点16.83℃,沸点44.8℃。
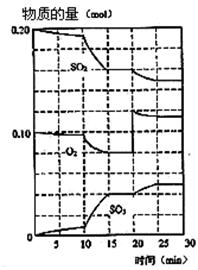
(1)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2,O2,SO3物质的量变化如图。
①该反应的化学平衡常数表达式 K=???
②该反应能自发进行的原因是???。
③据图判断,该反应处于平衡状态的时间是???。
④据图判断,反应进行至20 min时,曲线发生变化的原因是????????????????????????(用文字表达)。
(2)某化学研究学习小组用下图的装置组装设计了一个实验,以测定SO2转化为SO3的转化率,仪器的连接顺序是a→h→i→b→c→f→g→d→e。

①为提高SO2的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是???。
②在Ⅰ处用大火加热烧瓶时SO2的转化率会???。(填“填大”“不变”或“减小”)
③用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重 m g,则本实验中SO2的转化率为???。
参考答案:(1)① 本题解析:(1)①平衡常数是指可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,因此该反应的平衡常数表达式为
本题解析:(1)①平衡常数是指可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,因此该反应的平衡常数表达式为 。
。
②由于反应是放热反应,所以是可以自发进行。
③平衡时正逆反应速率是相等,因此物质的浓度是不变的,所以根据图像可判断,处于平衡状态的是15—20min和25—30min。
④由图像可以看出,在20min时,氧气的浓度突然变大,而SO2和三氧化硫的物质的量不变。随后三氧化硫的物质的量逐渐增大,氧气和二氧化硫的物质的量逐渐减小。这说明是通过增大氧气的浓度,使平衡向正反应方向移动的。
(2)①Ⅰ是制备二氧化硫的,Ⅱ是氧化二氧化硫的,所以为了提高二氧化硫的转化率,应该是先加热Ⅱ处催化剂,然后再滴入浓硫酸。
②在Ⅰ处用大火加热,则二氧化硫的生成速率过快,氧化二氧化硫的效率就底,转化率就降低。
③Ⅲ是用来吸收没有反应的二氧化硫,n mol Na2SO3可生成n mol二氧化硫,设转化率是x,则(n-nx)×64=m,解得x=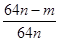 。
。
本题难度:一般
3、选择题 向甲、乙两个容积均为1 L的恒容容器中,分别充入2 mol A,4 mol B和1 mol A,2 mol B。相同条件下,发生下列反应:A(g)+2B(g) xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示,下列说法正确的是????????? ( )
xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示,下列说法正确的是????????? ( )

A.x可能等于3
B.向平衡后的乙容器中充入氦气可使A的转化率降低
C.将乙容器单独升温,c(A)可达到0.78 mol/L
D.若向甲容器中再充入2 mol A,4 mol B,平衡时甲容器中c(A)大于1.56 mol/L
参考答案:C
本题解析:分析可知甲装置相当于在乙装置基础上加压,但比乙中A浓度的2倍小,说明平衡正移,正向为气体体积减小的反应,所以可知x不能等于3,只能小于3,A错;恒温恒容,通惰性气体,平衡不移动,转化率不变,B错;升温,平衡逆向移动,c(A)增大,可达到0.78 mol/L,C正确;若向甲容器中再充入2 mol A,4 mol B,平衡正向移动,c(A)小于1.56 mol/L,D错。
本题难度:一般
4、填空题 (l2分)一定条件下,在体积为3L的密闭容器中反 应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态。
应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态。
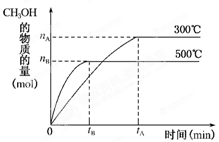
(1)500℃时,从反应开始到达到化学平衡状态,以H2的浓度变化表示的化学反应速率是________(用nB、tB表示)。
(2)判断该可逆反应达到化学平衡状态的标志是________(填字母)。a.?v生成(CH3OH)=v消耗(CO),? b. 混合气体的密度不再改变
c. 混合气体的平均相对分子质量不再改变??????? d. CO、H2、CH3OH的浓度均不再变化
(3)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是________(填字母)。
a. c(H2)减小??????????????????????????b. 正反应速率加快,逆反应速率减慢,
c. CH3OH的物质的量增加?????????????? d. 重新达到平衡时,c(H2)/c(CH3OH)减小
(4) 该反应的ΔH????0(选填>、<),理由是??????????????????????????????。
参考答案:(每空2分,共12分) ??(1)mol·L-1·min-1
本题解析:略
本题难度:一般
5、选择题 人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力.CO吸入肺中发生反应:CO+HbO2???? O2+HbCO,37℃时,该反应的平衡常数K=220。若HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损.据此下列结论错误的是(???)

A.CO与HbO2反应的平衡常数K=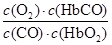
B.人体吸入的CO越多,与血红蛋白结合的O2越少
C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动
参考答案:C
本题解析:
试题分析:A.平衡常数等于生成物浓度幂之积除以反应物浓度幂之积,则平衡常数K=c(O2) ?c(HbCO)/ c(CO)?c(HbO2) ,故A正确;B.人体吸入的CO越多,CO的浓度增大,平衡向正反应分析移动,与血红蛋白结合的O2越少,故B正确;C.当吸入的CO与O2浓度之比大于或等于0.02时,根据平衡常数K=c(O2) ?c(HbCO)/ c(CO)?c(HbO2) 可知,c(HbCO) 0.02×c(HbO2) =220,c(HbCO) c(HbO2) =4.4,智力早就受到伤害了,故C错误;D.CO中毒的病人放入高压氧仓中,氧气的浓度增大,平衡向左移动,故D正确
本题难度:一般