微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (6分)在一定温度下的某容积可变的密闭容器中,建立下列化学平衡:
C(s)+H2O(g)
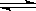 CO(g)+H2(g)
CO(g)+H2(g)
试分析和回答下列问题:
(1)可认定上述可逆反应在一定条件下已达到化学平衡状态的是????(选填序号)。
A?体系 的压强不再发生变化
的压强不再发生变化
B? v正(CO)=v逆(H2O)
C?生成n molCO的同时生成n mol H2
D? 1mol H-H键断裂的同时断裂2mol H-O键
(2)若上述化学平衡状态从 正反应开始建立,达到平衡后,给平衡体系加压(缩小容积.其它条件不变。下同),则容器内气体的平均相对分子质量面将?????(填写不变.变小.变大)。
正反应开始建立,达到平衡后,给平衡体系加压(缩小容积.其它条件不变。下同),则容器内气体的平均相对分子质量面将?????(填写不变.变小.变大)。
(3)若上述化学平衡状态从正.逆两反应同时建立[即起始时同时投放C(s).H2O(g).CO(g).H2(g)],达到平衡后,试讨论:
①容积内气体混合物的平均相对分子质量 的取值范围是?????????????。
的取值范围是?????????????。
②若给平衡体系加压,请参照起始投放的气体物质的平均相对分子质量(设定为 1),分别给出
1),分别给出 的变化:(填“增大”.“减小”.“不变”)
的变化:(填“增大”.“减小”.“不变”)
 1的取值 1的取值
|  的变化 的变化
|
 1<12 1<12
| ?
|
 1=12 1=12
| 不变
|
 1>12 1>12
| ?
参考答案:(6分)
(1)B.D(1分)???(2)变大(1分)
本题解析:略
本题难度:一般
2、填空题 (14分)Ⅰ.2011年11月28日至12月9日,联合国气候变化框架公约第17次缔约方会议在南非德班召开,随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
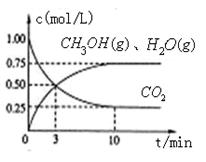
(1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3.25 mol H2,在一定条件下发生反应,测定CO2、CH3OH(g)和H2O (g)的浓度随时间变化如图所示:
①写出该工业方法制取甲醇的化学反应方程式 。
②从反应开始到平衡,氢气的平均反应速率v (H2)= ??????? 。 。
③该条件下CO2的转化率为 ??????????????。当温度降低时CO2的转化率变大,则该反应???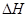 ??0(填“>”“<”或“=”)。 ??0(填“>”“<”或“=”)。
④下列措施中能使n(CH3OH)/n(CO2)增大的是 。
A.升高温度
B.充入氮气
C.将水蒸气从体系中分离
D.用更有效的催化剂
(2)选用合适的合金作为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此燃料电池负极的电极方程式为 。
Ⅱ.研究NO2 ?、SO2 、CO等大气污染气体的处理具有重要意义。其中氮元素有着多变价态和种类多的化合物,它们在工农业生产、生活中发挥着重要的作用。完成下列问题:
(1)已知:2SO2(g) + O2(g) 2SO3(g)? ΔH=" —196.6" kJ·mol―1 2SO3(g)? ΔH=" —196.6" kJ·mol―1
2NO(g) + O2(g) 2NO2(g)? ΔH= —113.0 kJ·mol―1 2NO2(g)? ΔH= —113.0 kJ·mol―1
则反应NO2(g) + SO2(g) SO3(g) + NO(g) 的ΔH= ???????????????????????。 SO3(g) + NO(g) 的ΔH= ???????????????????????。
(2)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,
①下列能说明反应达到平衡状态的是?????????????(填序号) 。
a.体系压强保持不变?????????????? b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变????? d.相同时间内,每消耗1 molNO2的同时消耗1 mol SO3
②当测得上述反应平衡时NO2与SO2体积比为1: 6,则平衡常数K=???????????。
参考答案: 本题解析:I.(1)① 根据反应物和生成物可知,方程式为 CO2 + 3H2 ?CH3OH + H2O。 ?CH3OH + H2O。
②平衡时生成甲醇是0.75mol/L,所以根据方程式可知,消耗氢气是0.75mol/L×3=2.25mol/L,因此其反应速率是2.25mol/L÷10min=0.225 。 。
③根据图像可知,消耗CO2是0.75mol/L,素其转化率是0.75mol/L÷1.0mol/L×100%=75%。温度降低时CO2的转化率变大,说明降低温度平衡向正反应方向移动,所以正反应是放热反应。
④升高温度平衡向逆反应方向移动,n(CH3OH)/n(CO2)降低,A不正确。充入氮气,平衡不移动,B不正确。将水蒸气从体系中分离,相当于降低生成物浓度,平衡向正反应方向移动,n(CH3OH)/n(CO2)增大,C周期。催化剂不能影响平衡状态,D不正确,答案选C。
(2)原电池中负极失去电子,所以甲醇在负极通入。由于电解质溶液显碱性,所以负极电极反应式为CH3OH-6 e- + 8OH- =CO32-????+?6H2O
II.(1)考查盖斯定律的应用。(①-②)÷2即得到O2(g) + SO2(g) SO3(g) + NO(g),所以反应热是(—196.6 kJ·mol―1+113.0 kJ·mol―1)÷2=-41.8 kJ·mol-1. SO3(g) + NO(g),所以反应热是(—196.6 kJ·mol―1+113.0 kJ·mol―1)÷2=-41.8 kJ·mol-1.
(2)①在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。颜色深浅和浓度有关系,所以b正确。反应前后羰基不变,所以压强也是随着不变的,a不正确。平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,所以c不正确。d中 反应速率的方向相反,且满足速率之比是相应的化学计量数之比,正确。答案选bd。
②???????????????NO2(g) + SO2(g) SO3(g) + NO(g) SO3(g) + NO(g)
起始量(mol)???? 1???????? 2?????????? 0??????? 0
转化量(mol)????? x??????? x?????????? x??????? x
平衡量(mol)??? 1-x???? 2-x?????????? x?????? x
所以有(1-x)︰(2-x)=1︰6,解得x=0.8,所以平衡常数是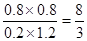 。 。
本题难度:一般
3、选择题 某温度下在密闭容器中发生如下反应: 2A(g)+ B(g) 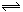 2C(g)若开始时只充入2molC(g),达平衡时,混合气体的压强比起始时增加20%,若开始时只充入2molA和1molB的混合气体,达平衡时A的转化率为(???) 2C(g)若开始时只充入2molC(g),达平衡时,混合气体的压强比起始时增加20%,若开始时只充入2molA和1molB的混合气体,达平衡时A的转化率为(???)
A.20%
B.40%
C.60%
D.80%
参考答案:C
本题解析:通入2molC与通入2molA和1molB是等效平衡。压强之比等于物质的量之比,物质的量增加2mol×20%=0.4mol故生成A0.8mol。如从正向反应,反应A为1.2mol,转化率为=60%
本题难度:一般
4、填空题 在4L体积不变的密闭 容器中充入6molA气体和5molB气体,发生反应: 容器中充入6molA气体和5molB气体,发生反应:
3A (g) + B (g)? ???2C (g) + x D (g), 2分钟后反应达到平衡,生成了2molC,经测定D的浓度为0.25mol·L-1, 求: ???2C (g) + x D (g), 2分钟后反应达到平衡,生成了2molC,经测定D的浓度为0.25mol·L-1, 求:
(1) x= ???????????。
(2) 用B表示的2分钟内的平均反应速率______________________。
(3)达到平衡时 ,在相同温度下容器内混合气体的压强与反应前压强比为?????????。 ,在相同温度下容器内混合气体的压强与反应前压强比为?????????。
(4)达到平衡状态时B的转化率为????????????。
参考答案: 本题解析:略 本题解析:略
本题难度:简单
5、计算题 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。某温度下,
SO2(g)+ 1/2O2(g) SO3(g);△H=-98 kJ·mol-1。开始时在100 L的密闭容器中加入4.0 mol SO3(g);△H=-98 kJ·mol-1。开始时在100 L的密闭容器中加入4.0 mol
SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,求该反应在该温度下平衡常数K
参考答案:10/3或3.33
本题解析:
本题难度:一般
|