微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 :如图所示,在一定温度下,把2体积N2和6体积H2通入一个带有活塞的容积可变的容器中,活塞的一端与大气相通,容器中发生以下反应: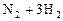

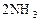 (正反应放热),若反应达到平衡后,测得混合气体的体积为7体积。据此回答下列问题:
(正反应放热),若反应达到平衡后,测得混合气体的体积为7体积。据此回答下列问题:

(1)保持上述反应温度不变,设a、b、c分别代表初始加入的N2、H2和NH3的体积,如果反应达到平衡后混合气体中各气体的体积分数仍与上述平衡相同,那么:
①若a=1,c=2,则b=_________。在此情况下,反应起始时将向_________(填“正”或“逆”)反应方向进行。
②若需规定起始时反应向逆反应方向进行,则c的取值范围是_________。
(2)在上述装置中,若需控制平衡后混合气体为6.5体积,则可采取的措施是_________,原因是_________。
参考答案:(1)①b="3?" 逆?? ② 本题解析:(1)①化学反应:
本题解析:(1)①化学反应:

 本题难度:一般
本题难度:一般
2、填空题 向某密闭容器中加入0.15mol/L A、0.05mol/L C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如下图中甲图所示[t0时c( B)未画出,t1时增大到0.05mol/L]。乙图为 t2时刻后改变反应条件,平衡体系中正、逆反应速率随时间变化的情况。
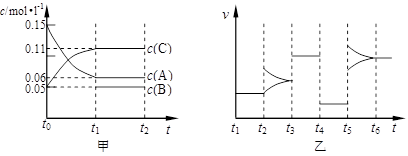
(1)若t4时改变的条件为减小压强,则B的起始物质的量浓度为??????????mol/L;
该反应的平衡常数表达式为K=?????????????????????。
(2)若t5时改变的条件是升温,此时v(正) > v(逆),平衡常数K的值将????????(选填“增大”、“减小”或“不变”)。
(3)若 t1= 15s,则t0~ t1阶段以C 浓度变化表示的平均反应速率为v(C)=??????????????
mol/L·s。t3时改变的某一反应条件可能是???????(选填序号)。
a.使用催化剂????? b.增大压强???c.增大反应物浓度????? d.降低产物浓度
(4)若A的物质的量减少0.02mol时,容器与外界的热交换总量为a kJ,写出该反应的热化学方程式????????????????????????????????????????????????????????????。
参考答案:(1)0.02 mol/L; (1分)?? K=[ B] ·
本题解析:
试题分析:
(1)根据甲图物质的变化量之比,可知A、C的计量数之比为3:2 ,t4时改变的条件为减小压强,但平衡不移动,说明左右两边气体分子数相同,因此B为生成物,系数为1,则起始浓度0.02 mol/L;?平衡常数表达式为K=[ B] ·[ C]2/ [ A]3。
(2)升温平衡正移,说明反应正向吸热,平衡常数K的值增大。?????
(3)v(C)= △c(C)/ △t=0.004mol/L·s??; t3时改变的某一反应条件,正逆反应速率增大,平衡不移动,只有a、 b 符合
本题难度:困难
3、选择题 将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:
2SO2(g)+O2(g)?
催化剂
△
?2SO3(g)(正反应放热).判断该反应达到平衡状态的标志是( )
A.SO2和SO3浓度相等
B.SO2百分含量保持不变
C.容器中气体的压强不变
D.SO3的生成速率与SO2的消耗速率相等
参考答案:A、可逆反应到达平衡时SO2和SO3浓度不一定相等,与二氧化
本题解析:
本题难度:一般
4、填空题 在体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
CO(g)十H2O(g) 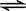 ?CO2(g)十H2 (g)????△H<0?, CO和H2O浓度变化如下图,
?CO2(g)十H2 (g)????△H<0?, CO和H2O浓度变化如下图,
(1) 3min—4min之间反应处于____状态(填平衡、不平衡);
(2)要使反应在8min后,平衡向逆方向移动,可采取的措施是__? ___,要使反应在8min后,反应速率降低,平衡向正方向移动,可采取的措施是________。(填a,b,c,d)
a.增加水蒸气? b.降低温度 ??c.使用催化剂? d.增加氢气浓度
(3)求出850℃ 时,该反应的平衡常数和CO的平衡转化率(写出详细计算过程)
参考答案:(1)???不平衡???(2)???? d????,????
本题解析:
试题分析:
(1)由图可知3min—4min之间物质的浓度在变化。所以不平衡
(2)a.增加水蒸气,衡向正方向移动 b.降低温度,平衡向逆方向移动?? c.使用催化剂,不改变平衡。? d.增加氢气浓度,反应速率降低,平衡向正方向移动。
(3)???????????? CO(g)?十 H2O(g)??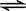 本题难度:一般
本题难度:一般
5、选择题 在一定的温度下,可逆反应A(g)+3B(g)

??2C(g)??达到平衡的标志是( )
A.单位时间生成nmolA,同时生成nmolC
B.A、B、C的分子数之比为1:3:2
C.单位时间生成nmolA,同时生成3nmolB
D.A、B、C的浓度不再变化
参考答案:A.对可逆反应A(g)+3B(g)
![</p]()
本题解析:
本题难度:简单