微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)==CO(g)+H2O(g)。其化学平衡常数K和温度t的关系如下表:
t℃
| 700
| 800
| 830
| 1000
| 1200
|
K
| 0.6
| 0.9
| 1.0
| 1.7
| 2.6
回答下列问题:
(1)该反应的化学平衡常数表达式为K=?????????????????????????。
(2)该反应为????????????反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是??? ??????????????????????。 ??????????????????????。
a.?容器中压强不变???????? b.?混合气体中c(CO)不变
c.?v正(H2)=v逆(H2O)???? d.??c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2 )·c(H2)=c(CO)·c(H2O)。试判断此时的温度为_____________ )·c(H2)=c(CO)·c(H2O)。试判断此时的温度为_____________
参考答案:
 本题解析:略 本题解析:略
本题难度:一般
2、选择题 在密闭容器中可逆反应aA(g)+bB(g)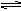 cC(g)+dD(g);△H>0,达到化学平衡时,若升高温度或降低压强,都会使C的物质的量增大,则下列各组关系正确的是(????) cC(g)+dD(g);△H>0,达到化学平衡时,若升高温度或降低压强,都会使C的物质的量增大,则下列各组关系正确的是(????)
A.a+b<c+d,△H>0
B.a+b>c+d,△H>0
C.a+b<c+d,△H<0
D.a+b=c+d,△H>0
参考答案:A
本题解析:C的物质的量增大的方向是正反应方向,而升高温度,平衡会向吸热反应方向移动,即正反应方向为吸热反应方向;降低压强,平衡会向气体系数增大的反应方向移动,即正反应方向为气体系数增大的反应方向。故a+b<c+d,△H>0。
本题难度:一般
3、选择题 在某密闭容器中投入X、Y进行如下反应:X(g)+2Y(g) 2Z(g),若要使平衡时反应物总物质的量与生成物总物质的量相等,则X、Y的初始物质的量x、y之比应满足 2Z(g),若要使平衡时反应物总物质的量与生成物总物质的量相等,则X、Y的初始物质的量x、y之比应满足
A.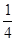 < < < <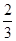
B.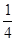 < < < <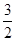
C.3< <4 <4
D.1< <3 <3
参考答案:B
本题解析:本题考查化学平衡计算,难度中等。
令参加反应的X的物质的量为n,
X(g)+2Y(g) ?2Z(g), ?2Z(g),
开始(mol):x????? y???????????????? 0
转化(mol):n????? 2n??????????????? 2n
平衡(mol):x-n??? y-2n?????????????? 2n
平衡时反应物总物质的量与生成物总物质的量相等,所以有x-n+y-2n=2n,
解得n=(X+y)/5
反应物不能完全反应,所以有X>n,Y>2n,
即X>(X+y)/5???(1),Y>2(X+Y)/5?(2)
解(1)得:X/Y>1/4, 解(2)得:X/Y<3/2,
所以??1/4<X/Y<3/2
B正确,故本题选B.
本题难度:一般
4、填空题 有一化学反应aA+bB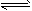 C,根据影响化学反应速率的因素可得v0=K{c(A)}m·{c(B)}n,其中K是与温度有关的常数。为测K、m、n的值,在298K时,将A、B溶液按不同浓度混合,得到下列实验数据 C,根据影响化学反应速率的因素可得v0=K{c(A)}m·{c(B)}n,其中K是与温度有关的常数。为测K、m、n的值,在298K时,将A、B溶液按不同浓度混合,得到下列实验数据
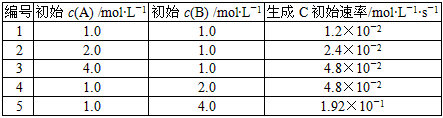
(1)根据上表可求得m=__________,n=__________,K=__________________。
(2)若a=m,当c(A)=c(B)=2mol·L-1时,求以B表示的初始反应速率。
____________________
参考答案:(1)1;2;1.2×10-2
(2)v(B)=1.9
本题解析:
本题难度:一般
5、填空题 (14分) 在温度为373K时,将0.400 mol无色的N2O4气体通入4 L抽空
的密闭容器中,立刻出现红棕色,直至建立N2O4 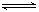 2NO2??的平 2NO2??的平
衡。右图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,
横坐标为时间)(1)该反应的化学平衡常数表达式为K =?????????????。此温度下,K值=??????。
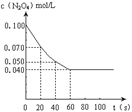
(2)计算在0至20秒时间内,NO2的平均生成速率为????????mol?L-1?s-1。
(3)下表是不同温度下测定得到的该反应的化学平衡常数。
|